自2021年5月1日,国家药品监督管理局要求化妆品注册人、备案人、境内责任人,通过新注册备案平台申请特殊化妆品注册和普通化妆品备案。使用的化妆品新注册备案平台与旧化妆品注册备案系统操作模式有较大改变,且因普通化妆品和特殊化妆品监管方式不同、系统开发团队不同,导致企业需重新适应普通化妆品备案和特殊化妆品注册流程。
一、普通化妆品备案和特殊化妆品注册的系统操作流程是什么?
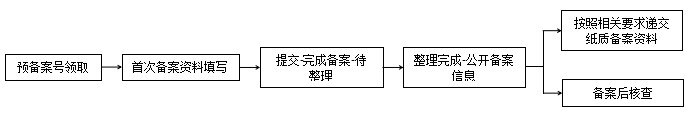
普通化妆品备案前,需预先领取备案号,然后在化妆品备案系统中进行备案申请资料填写,提交后即完成备案,若提交的资料符合备案资料要求,则公开备案信息;若不符合,相关监管部门可要求企业责令改正。现阶段,对于公开备案信息的产品:进口普通化妆品应根据相关要求递交纸质备案资料,国产普通化妆品的纸质版备案资料可以由境内备案人或者境内责任人存档备查。
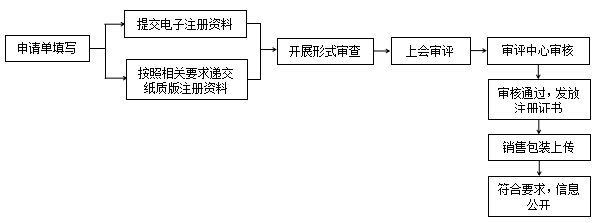
特殊化妆品注册时首先进行申请单及相关资料填写,填写完成提交电子注册资料后,需按照相关要求将纸质资料递交至国家药品监督管理局行政事项受理服务机构。根据《化妆品注册备案资料提交技术指南(试行)》中相关内容,受理机构收到电子版和纸质版注册资料后,按照相关规定开展形式审查工作。但实际操作过程中,电子注册资料提交后,受理机构就会开展形式审核,待审核通过后,企业再递交纸质资料。
在提交纸质资料时,需同时提交一致性声明,自我声明所提交纸质资料与信息服务平台填报内容的一致性,并由注册人或备案人签章确认。
具体操作流程如下:
① 普通化妆品备案系统操作流程:
② 特殊化妆品注册系统操作流程:
二、普通化妆品备案和特殊化妆品注册的资料要求有什么区别?
普通化妆品和特殊化妆品在化妆品注册备案信息服务平台申请的资料基本一致,根据《化妆品注册备案资料管理规定》,系统中需提交7部分资料:《化妆品注册备案申请表》及相关资料、名称命名依据、配方、执行的标准、标签、检验报告、产品安全评估资料。
因普通化妆品备案和特殊化妆品注册在系统操作时,为两个不同端口。现阶段提交资料存在很多实际操作的不同点,主要有:
1) 执行的标准中的生产工艺
• 普通化妆品的原料分组需要企业自行以文字形式填写原料分组情况。
• 特殊化妆品的原料分组可在系统中直接进行原料选择分组,无需额外进行分组信息文字内容填写。
2) 检验报告
• 普通化妆品的检验报告由企业自行上传。
• 特殊化妆品的检验报告现阶段已实现与化妆品注册备案检验系统关联,企业只需另外上传检验受理通知书、申请表等检验申请资料即可。
3)各文件的盖章/签字确认要求
• 普通化妆品备案时,除系统中要求上传的文件,如上市包装、安评报告外,系统中填写的各项资料,仅申请表需另外生成文件并由备案人盖章确认,进口普通化妆品还需境内责任人盖章确认。但因现阶段各地方局要求不同,也存在部分地方局老师要求所有填写资料全部需备案人盖章确认的情况。
• 特殊化妆品注册时,所有项目资料在系统中填写完成后,需保存填报的信息后再上传附件,并由注册人或境内责任人盖章确认。需要注意的是:进口特殊化妆品的资料可由境内责任人加盖公章确认,但是申请表和执行的标准文件需由境外注册人同时确认。
近期特殊化妆品注册系统进行了提交升级优化:将原来一步提交细分为两步提交。
- 第一步:申请人先进行系统中注册信息填写,保存填报的信息,申请单管理列表出现一个【上传附件】按钮。
- 第二步:在申请单管理页面的【上传附件】完成系统生成附件的下载后盖章回传或签章。
最后点击该页面【提交】按钮完成注册申请。此外,保存填报的信息后若需要修改申请信息,会重新生成申请编号,则所有资料需要重新进行下载盖章上传。
三、普通化妆品备案和特殊化妆品注册时递交产品包装信息有什么区别?
普通化妆品在备案时需在标签项目中上传产品上市销售包装平面图、上市销售包装立体图和和产品说明书,进口产品还涉及原销售包装平面图、原销售包装译文。加贴中文标签的产品无需再另外上传产品中文标签。
特殊化妆品在注册时只需提供产品的原销售包装及其说明书和相对应的译文供审评即可。待取得产品注册证后,在化妆品智慧申报系统中上传产品上市销售包装平面图和立体图。
四、现阶段普通化妆品备案和特殊化妆品注册系统中可进行哪些项目?
普通化妆品备案系统 | 特殊化妆品注册系统(化妆品智慧申报审评系统) |
首次备案申请 备案变更申请 历史产品信息补充 备案注销申请 委托关系确认 新原料授权申请状态查询 历史产品确认等 备注:备案变更申请可依据法规进行相关资料信息变更 | 首次注册申请 变更申请 延续申请 纠错申请 注销申请 撤回申请 终止申请 补发申请 再次注册申请 销售包装上传 受托企业管理 产品验证等 备注:企业变更栏,可进行化妆品注册证批量变更或单品的注册人、境内责任人更换。 |
五、新系统下如何添加进口口岸和收货人信息?
现阶段针对在旧化妆品注册备案系统中完成备案但未补录的产品暂时不能进行补充进口口岸和收货人的操作。在确认产品的生产企业后,目前需要完成的产品补录信息有产品分类、产品执行的标准和产品标签样稿。
此外,新规系统引入数据维护管理端口,原料、产品的质量控制简要说明等相关信息可在该端口进行更新和维护。普通化妆品系统中为常用信息维护端口,含补充进口口岸和收货人、商标维护、微生物指标和理化指标简要说明维护、原料安全相关信息管理。特殊化妆品系统中为支撑数据管理端口,含质量管理措施信息维护、商标管理、原料安全相关信息管理、使用目的申请。
因化妆品注册备案平台系统上线时间较短,系统暂未成熟,国家局为帮助大家及时快速解决化妆品注册备案相关问题,也提供了相应的操作手册和咨询通道供企业参考答疑,企业可根据自身碰到的实际问题进行咨询:
企业信息资料管理系统操作手册下载:点击下载
普通化妆品备案管理操作手册下载:点击下载
常见问题解答:点击查看
企业信息资料管理、普通化妆品备案管理系统:
- 咨询电话:010-88331913
- 邮箱:gcftba@nmpa.gov.cn
化妆品智慧申报审评系统:
- 咨询电话:010-83636828
- 邮箱:hukang@nifdc.org.cn
相关推荐:
- 技术评价人员划重点!拉直化妆品新原料注册备案诸多“?”
- 化妆品注册备案常见技术核查意见梳理(一)
- 化妆品注册备案旧平台即将关闭!
- 4个化妆品新原料成功备案 化妆品企业研发创新迎来新机
- 上海市药品监督管理局关于暂停3家检验检测机构的化妆品注册和备案检验信息系统使用权限的通告
