质量抽查
2017年,总局共发布29期国家医疗器械质量公告,想比16年,抽查次数增加近2倍,抽查频次大大增加。
2017年共组织对92个品种3083批产品进行了质量抽检,共274批(台)产品不符合质量标准或说明书、标识标签不符合要求,总体不合格率8.89%。
2017年召回中多次出现了因为质量抽检不合格而召回的产品,质量抽检越来越重要,这也是总局对于医疗器械上市后监管的重要手段之一。
召回情况
1.法规变化情况
2017年2月8号,总局发布了《医疗器械召回管理办法》(国家食品药品监督管理总局令第29号),自2017年5月1日起开始实施。
《办法》的修订,保留了《办法(试行)》的框架和主要内容,依据《条例》,重点对召回的范围和个别操作程序作了补充和调整,强化了生产企业的主体责任和法律责任,加大了对违法违规行为的惩处力度,主要修改内容包括:
(一)落实了医疗器械召回的责任主体。明确境内医疗器械产品注册人或者备案人、进口医疗器械的境外制造厂商在中国境内指定的代理人是实施医疗器械召回的主体。
(二)明确了适用范围。将《办法(试行)》中的使用范围由“在我国销售”改为“在我国上市”,明确了凡在我国注册的医疗器械产品,在境内或者境外发生召回的,都应当按照本《办法》的要求实施或报告。
(三)调整缺陷产品的范围。《办法》根据新修订的《条例》,将缺陷产品的范围扩展为“(一)正常使用情况下存在可能危及人体健康和生命安全的不合理的风险的产品;(二)不符合强制性标准、经注册或者备案的产品技术要求的产品;(三)不符合医疗器械生产、流通质量管理有关规定导致可能存在不合理风险的产品;(四)其他需要召回的产品”。
(四)增加了缺陷评估内容。对应扩大缺陷产品范围的修改,在对医疗器械缺陷进行评估的主要内容方面,增加了“产品是否符合强制性标准、经注册或者备案的产品技术要求”一项。
(五)调整了监督召回产品销毁的监管部门。《办法(试行)》中规定“需要销毁的,应当在销毁地药品监督管理部门监督下销毁”。但在实践中,此方式不利于实际操作。因此,《办法》修改为“需要销毁的,应当在食品药品监督管理部门监督下销毁。”
(六)调整了召回信息通报的要求。《办法》取消书面形式通知生产企业的要求,将向卫生行政部门的信息通报修改为“必要时向同级卫生行政部门通报相关信息”。
2. 2107年召回情况
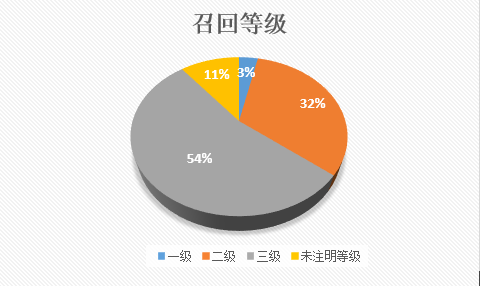
截至2017年12月29号,总局共发布235条召回信息(官网部分信息多次报告),其中三级召回126项,占总体54%,二级召回76项,占总体32%;一级召回8项,占总体3%;部分召回信息未标明召回等级,系未在中国销售的产品。
分析召回原因,一大部分是由于产品质量、性能的缺陷,在生产过程中的错误或是原料出现问题等情况,导致产品的性能受到影响,达不到产品标准。除此之外,产品说明书、标签的错误导致的召回也占了较大比重,说明书标签上缺少必要内容或印刷错误等。今年的召回信息中还出现的部分由于国家质量抽检不符合标准规定的产品。
