2021年6月,新版《医疗器械监督管理条例》(国务院第739号令)施行,明确规定“进行医疗器械临床评价,可以根据产品设计特征、临床风险、已有临床数据等情形,通过开展临床试验,或者通过对同品种医疗器械临床文献资料、临床数据进行分析评价,证明医疗器械安全、有效”。
2021年9月,国家药监局发布医疗器械临床评价配套规范性文件,其中《决策是否开展医疗器械临床试验技术指导原则》(2021年第73号,以下简称“《决策导则》”,见附件1)从“高风险医疗器械”、“新型医疗器械”、“已有证据的充分性”三个方面指导申请人决策申报产品是否需要开展临床试验。
为进一步指导申请人确定具体产品的临床评价路径,器审中心根据目前已有产品的审评经验,基于《医疗器械分类目录》中的子目录12有源植入器械和13无源植入器械的产品描述、预期用途和品名举例,编写了《基于<医疗器械分类目录>子目录“12有源植入器械”临床评价推荐路径》(见附件2)和《基于<医疗器械分类目录>子目录“13无源植入器械”临床评价推荐路径》(见附件3),给出具体产品临床评价路径选择的推荐意见。对于产品数量较少,近几年无相关产品申报的,暂未在该文件中体现。
文件中标注“临床试验”的产品,基于目前认知,通常为《决策导则》中的“高风险医疗器械”,除该指导原则第三部分第(一)款中可考虑免于开展临床试验的情形,原则上需要开展临床试验。
文件中标注“同品种”的产品,如申报产品与同品种医疗器械相比,适用范围、技术特征和/或生物学特性等方面具有显著差异,属于《决策导则》中提出的“新型医疗器械”,除《决策导则》第三部分第(二)款中可考虑免于开展临床试验的情形,需提交申报产品的临床试验资料。
文件中标注“同品种”的产品,如不属于《决策导则》中提出的“新型医疗器械”,申请人可按照《医疗器械临床评价技术指导原则》《医疗器械临床评价等同性论证技术指导原则》《医疗器械注册申报临床评价报告技术指导原则》(2021年第73号)的相关要求,根据申报产品特征、临床风险、已有临床数据等情形,选取合适的同品种医疗器械,通过对同品种医疗器械临床数据进行分析评价,证明医疗器械的安全性、有效性。此种情形下,如通过非临床研究未能证明差异性部分的安全有效性,即《决策导则》中提出的“已有证据不能证明产品符合医疗器械安全和性能基本原则”,需提交申报产品的临床试验资料。
为便于注册申请人查询,在推荐路径表单中标注了《免于临床评价医疗器械目录的通告》(2021年第71号)相关内容。是否可免于进行临床评价,需按照《免于临床评价医疗器械目录》进行判定。
我中心将根据医疗器械风险变化,参考国际经验,遵循最新科学认知,立足监管实际,对相关产品的临床评价推荐路径进行动态调整。
目前,除首批公布的《医疗器械分类目录》子目录“12有源植入器械”和“13无源植入器械”相关产品临床评价推荐路径,对于《医疗器械分类目录》中其他子目录产品的临床评价推荐路径,我中心正在组织编写,拟逐步公布。<医疗器械分类目录><医疗器械分类目录>
附件1
决策是否开展医疗器械临床试验技术指导原则
决策是否开展医疗器械临床试验是综合考虑产品的适用范围、技术特征、生物学特性、风险程度及已有研究数据(包括临床数据和非临床数据)等方面来确定开展临床试验必要性的过程。需要开展临床试验的,可根据具体情况,选择在境内开展临床试验、全部或同期在境外开展临床试验。
本指导原则旨在为注册申请人和审查人员判断拟申请注册的产品是否需要开展临床试验提供技术指导,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
一、 适用范围
本指导原则适用于需要开展临床评价的第二类、第三类医疗器械产品注册时,是否需要开展临床试验的判定,不适用于按医疗器械管理的体外诊断试剂。
二、总则
在医疗器械设计开发过程中,设计确认是其重要环节,以确保产品能够满足规定的使用要求或者预期用途的要求。可采取多种方法实现设计确认,如模体试验、计算机模拟试验、动物试验、临床评价等。可用于临床评价的临床数据包括在境内或境外,合法的临床使用过程中生成的安全性、有效性信息,例如临床试验数据、临床文献数据和临床经验数据等。鼓励注册申请人采用最有效的方式获取证明符合医疗器械安全和性能基本原则所需的最少量信息,消除或减轻不必要的负担,可使患者能够及早并持续获得安全有效的医疗器械。临床试验的必要性应全面考虑医疗器械的适用范围、技术特征、生物学特性、风险程度、与现有医疗器械或现有诊疗方法的差异等方面,如果非临床研究的结果和/或现有临床数据不足以证明产品对医疗器械安全和性能的基本原则的符合性,则可能需要开展临床试验。基于良好设计和规范实施的临床试验能够提供科学、可靠的医疗器械安全有效性数据。
本指导原则提到的符合医疗器械安全和性能基本原则,是指对临床证据与其他设计验证和确认文件、器械描述、说明书和标签、风险管理文件以及生产信息进行综合评价后得出的结论。
三、考虑因素
(一) 临床使用具有高风险的第三类医疗器械(以下简称“高风险医疗器械”),原则上需要开展临床试验,但以下情形可考虑免于开展临床试验:
1.申报产品的前代产品未在中国获准上市,申报产品是对前代产品进行的设计变更,注册申请人可通过已有数据(如非临床研究数据、前代产品的临床试验数据、申报产品境外临床数据)证明申报产品符合医疗器械安全和性能基本原则。
2.注册申请人可按照《接受医疗器械境外临床试验数据技术指导原则》的要求提供申报产品境外临床试验数据,结合其他设计验证和确认文件、器械描述、说明书和标签、风险管理文件以及生产信息进行综合评价,证明申报产品符合医疗器械安全和性能的基本原则。
3.申报产品的前代产品已在中国获准上市,申报产品是对前代产品进行的设计变更,且注册申请人可通过已有数据(如非临床研究数据、前代产品的临床数据、申报产品境外临床数据)证明申报产品符合医疗器械安全和性能基本原则。
前代产品是指与申报产品属于同一注册申请人、具有相同适用范围且技术特征和生物学特性相似的产品,申报产品与前代产品为迭代关系。
(二)申报产品虽然不属于高风险医疗器械,但为新型医疗器械,原则上应开展临床试验,但以下情形可考虑免于开展临床试验:
1.注册申请人可通过非临床研究数据充分证明申报产品符合医疗器械安全和性能基本原则。
2.申报产品在我国为新型医疗器械,但其自身已有临床数据(例如境外临床文献数据、境外临床试验数据等),注册申请人可通过非临床研究数据、申报产品的临床数据证明申报产品符合医疗器械安全和性能基本原则。
3.申报产品在我国为新型医疗器械,但其前代产品已有境外临床数据,申报产品是对前代产品进行的设计变更,注册申请人可通过非临床研究数据、申报产品的境外临床数据和前代产品的境外临床数据充分证明申报产品符合医疗器械安全和性能基本原则。
新型医疗器械是指与已在中国境内获准上市的医疗器械相比,在适用范围、技术特征和/或生物学特性等方面具有显著差异的医疗器械。大部分医疗器械是一个渐进的变更过程,并不属于新型医疗器械,很多情形下,可以通过非临床研究来证明其符合医疗器械安全和性能的基本原则。
(三)产品不属于高风险医疗器械,也不属于新型医疗器械,在注册申请人已开展充分的非临床研究且全面收集已有临床数据的基础上,若已有证据不能证明产品符合医疗器械安全和性能的基本原则时,有可能需要通过开展临床试验补充临床数据。获得的临床试验数据用于产品临床评价过程且为临床证据的一部分。
例如,对于特定申报产品,其已有同品种产品在中国获准注册,申报产品与同品种产品存在差异。若注册申请人基于申报产品的非临床研究数据以及同品种产品的临床数据对产品实施了全面的临床评价,但仍不能证明申报产品符合医疗器械安全和性能的基本原则,则可能需要开展临床试验。
当注册申请人根据以上因素考虑是否开展医疗器械临床试验时,可参考《医疗器械临床试验决策流程图》(见附件)。
附件:医疗器械临床试验决策流程图
附件
医疗器械临床试验决策流程图
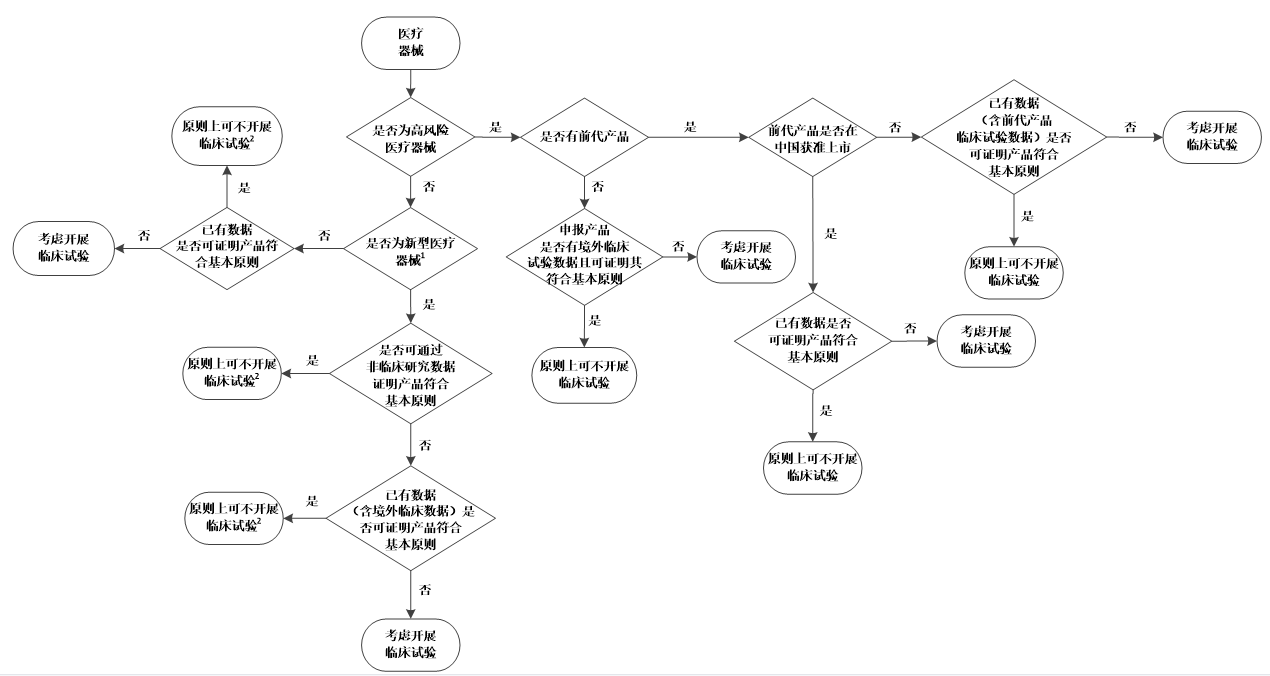
1.新型医疗器械描述见本指导原则三(二)。
2.原则上可不开展临床试验的,注册申请人需结合非临床研究、等同性论证(如需要)、临床评价(如需要)证明产品符合医疗器械安全和性能基本原则。
| 附件2 | |||||||||
| 基于《医疗器械分类目录》子目录“12有源植入器械”临床评价推荐路径 | |||||||||
| 序号 | 一级产品类别 | 二级产品类别 | 产品描述 | 预期用途 | 品名举例 | 管理类别 | 免临床评价 | 临床评价 | |
| 同品种 | 临床试验 | ||||||||
| 01 | 心脏节律管理设备 | 01植入式心脏起搏器 | 通常由植入式脉冲发生器和扭矩扳手组成。通过起搏电极将电脉冲施加在患者心脏的特定部位。 | 用于治疗慢性心率失常。再同步治疗起搏器还可用于心力衰竭治疗。 | 植入式心脏起搏器、植入式心脏再同步治疗起搏器 | III | 临床试验 | ||
| 02植入式心律转复除颤器 | 通常由植入式脉冲发生器和扭矩扳手组成。通过检测室性心动过速和颤动,并经由电极向心脏施加心律转复/除颤脉冲对其进行纠正。 | 用来治疗快速室性心律失常。再同步治疗除颤器还可用于心力衰竭治疗。 | 植入式心律转复除颤器、植入式再同步治疗心律转复除颤器、植入式皮下心律转复除颤器 | III | 临床试验 | ||||
| 03 临时起搏器 | 通常由非植入式脉冲发生器和患者电缆(若使用)组成。 | 用于心房和心室的体外临时起搏。 | 临时起搏器、体外起搏器 | III | 同品种 | ||||
| 04植入式心脏起搏电极导线 | 通常由电极导线和附件组成。 | 与植入式心脏起搏器配合使用,用于治疗慢性心律失常。 | 植入式心脏起搏电极导线、植入式左室心脏起搏电极导线、植入式心外膜心脏起搏电极导线 | III | 通常与配用的植入式心脏起搏器一起开展临床试验 | ||||
| 05植入式心脏除颤电极导线 | 通常由电极导线和附件组成。 | 与植入式心律转复除颤器配合使用,用于治疗快速室性心律失常。 | 植入式心脏除颤电极导线、植入式皮下心脏除颤电极导线 | III | 通常与配用的植入式心律转复除颤器一起开展临床试验 | ||||
| 06临时起搏电极导线 | 通常由电极导线和附件组成。 | 用于心房和心室的临时起搏。 | 临时心脏起搏电极导线 | III | 同品种 | ||||
| 07植入式心脏事件监测设备 | 通常由监测仪植入体本身和体外附件(若使用)组成。 | 植入于人体内记录皮下心电图和心律失常事件。 | 植入式心脏事件监测器、植入式心电事件监测器 | III | 临床试验 | ||||
| 08植入式封堵工具 | 通常由硅橡胶材料制成。 | 用于电极导线终端未使用连接器或植入式脉冲发生器未使用端口的绝缘。 | 封堵塞、电极导线帽 | III | 同品种 | ||||
| 10 起搏系统分析设备 | 通常由分析仪主机和患者电缆、电缆适配器、无菌延长线组成。 | 适合在起搏器和除颤器植入过程中用于对起搏电极系统进行分析。 | 起搏系统分析仪 | II | 同品种 | ||||
| 11 心脏节律管理程控设备 | 通常由显示单元、打印单元、程控单元、软件等组成。 | 用于询问、程控、显示数据或测试植入式心脏起搏器和植入式心律转复除颤器等心脏节律管理设备。 | 心脏节律管理设备程控仪、心脏节律管理设备患者程控仪、程控仪 | II | 通常与配用的心脏节律管理设备一起开展临床试验 | ||||
| 12连接器套筒 | 通常由接触夹及连接器环形电极组成。 | 用于连接到电极导线连接器、或者断开连接。 | 四极连接器套筒 | II | 同品种 | ||||
| 02 | 神经调控设备 | 01植入式神经刺激器 | 通常由植入式脉冲发生器和附件组成。 | 通过将电脉冲施加在脑部或神经系统的特定部位来治疗帕金森病、控制癫痫、躯干和/或四肢的慢性顽固性疼痛或肠道控制以及排尿控制、肌张力障碍等疾病。 | 植入式脑深部神经刺激器、植入式脊髓神经刺激器、植入式骶神经刺激器、植入式迷走神经刺激器、植入式可充电脑深部神经刺激器、植入式可充电脊髓神经刺激器、植入式可充电骶神经刺激器、植入式可充电迷走神经刺激器 | III | 临床试验 | ||
| 02植入式神经刺激电极 | 通常由电极导线和附件组成。 | 与植入式神经刺激器配合使用,用于治疗帕金森病、控制癫痫、躯干和/或四肢的慢性顽固性疼痛或肠道控制以及排尿控制、肌张力障碍等疾病。 | 植入式脑深部神经刺激电极、植入式脊髓神经刺激电极、植入式骶神经刺激电极、植入式迷走神经刺激电极、植入式脑深部神经刺激延伸导线、植入式脊髓神经刺激延伸导线、植入式骶神经刺激延伸导线、植入式迷走神经刺激延伸导线 | III | 通常与配用的植入式神经刺激器一起开展临床试验 | ||||
| 03测试刺激电极 | 通常由电极和附件(若使用)组成。 | 与测试刺激器配合使用,用于临时刺激与测试。 | 测试神经刺激电极、测试刺激电极、神经刺激测试电极 | III | 通常与配用的测试刺激器、植入式神经刺激器一起开展临床试验 | ||||
| 04神经调控充电设备 | 通常由充电器、充电线圈、适配器等组成。 | 用于对特定的可充电植入式脉冲发生器的电池进行充电,以延长可充电植入式脉冲发生器的使用期限。 | 神经调控体外充电器、体外充电器 | III | 同品种 | ||||
| 05植入式电极导线适配工具 | 通常由适配器、神经刺激器接口插头、转矩扳手组成。 | 用于连接植入式神经刺激器与适配的植入式延伸导线。 | 植入式电极导线适配器 | III | 同品种 | ||||
| 07测试刺激器 | 通常由控制单元、输出单元、电源单元组成。 | 用于在电极导线放置或试验刺激效果期间评估神经刺激系统的功效。 | 测试神经刺激器、测试刺激器、体外神经刺激器 | II | 通常与植入式神经刺激器一起开展临床试验 | ||||
| 08测试延伸导线 | 通常由延伸导线和附件(若使用)组成。 | 与测试刺激器、配合使用,用于临时刺激和测试。 | 测试神经刺激延伸导线、神经刺激系统经皮延伸导线和电缆、多电极测试电缆 | II | 通常与配用的测试刺激器、植入式神经刺激器一起开展临床试验 | ||||
| 09神经调控程控设备 | 通常由程控单元、显示单元、软件等组成。 | 用于对植入式神经调控设备的询问、程控、显示数据和测试。 | 神经调控设备程控仪、神经调控设备患者程控仪、程控仪、患者程控仪 | II | 通常与配用的植入式神经刺激器一起开展临床试验 | ||||
| 03 | 辅助位听觉设备 | 01植入式位听觉设备 | 通常由接收部分、刺激器主体和电极(若有)组成的植入体。 | 通过对耳蜗内或蜗后听觉传导通路特定部位进行电刺激,或对中耳以及骨传导进行振动来提高或恢复听觉感知。 | 人工耳蜗植入体 | III | 临床试验 | ||
| 02体外声音处理器 | 通常由言语处理器主机、控制器等组成的体外部分。 | 与植入式辅助听觉设备体配合使用,将声音转化为电刺激或振动,通过对耳蜗内或蜗后听觉传导通路特定部位进行电刺激,或对中耳以及骨传导进行振动来提高或恢复听觉感知。 | 人工耳蜗声音处理器 | II | 通常与配用的人工耳蜗一起开展临床试验 | ||||
| 03辅助位听觉调控设备 | 通常由主机,连接电缆等组成。 | 用于调试或测试辅助位听觉设备。 | 人工耳蜗调机设备、人工耳蜗检测设备 | II | 通常与配用的人工耳蜗一起开展临床试验 | ||||
| 04 | 其他 | 01植入式心脏收缩力调节设备 | 通常由植入式脉冲发生器和扭矩扳手组成,通过电极将电脉冲施加在患者心脏的特定部位。 | 用于心肌收缩力的调节增强。 | 植入式心脏收缩力调节器 | III | 临床试验 | ||
| 通常由充电器、充电线圈、适配器等组成。 | 用于对特定的植入式心脏收缩力调节设备电池进行充电,以延长其使用期限。 | 心脏收缩力调节设备充电器 | III | 通常与配用的植入式心脏收缩力调节设备一起开展临床试验 | |||||
| 通常由显示单元、程控单元、软件等组成。 | 用于询问、程控、显示数据或测试植入式心脏收缩力调节设备。 | 心脏收缩力调节设备程控仪 | II | 通常与配用的植入式心脏收缩力调节设备一起开展临床试验 | |||||
| 02植入式循环辅助设备 | 通常由植入式泵体、电源部分、血管连接和控制器组成。 | 用于心室循环功能的辅助,代替心脏实现泵血。 | 植入式左心室辅助装置、植入式右心室辅助装置 | III | 临床试验 | ||||
| 03植入式药物输注设备 | 通常由输注泵植入体、鞘内导管、附件等组成。 | 用于长期输入药物或液体。 | 植入式药物泵 | III | 临床试验 | ||||
| 附件3 | |||||||||
| 基于《医疗器械分类目录》子目录“13无源植入器械”临床评价推荐路径 | |||||||||
| 序号 | 一级产品类别 | 二级产品类别 | 产品描述 | 预期用途 | 品名举例 | 管理类别 | 免临床评价 | 临床评价 | |
| 同品种 | 临床试验 | ||||||||
| 01 | 骨接合植入物 | 01单/多部件金属骨固定器械及附件 | 通常由一个或多个金属部件(如板、钉板、刃板)及金属紧固装置(如螺钉、钉、螺栓、螺母、垫圈)组成。一般采用纯钛及钛合金、不锈钢、钴铬钼等材料制成。其中金属部件通过紧固装置固定就位。 | 用于固定骨折之处,也可用于关节的融合及涉及截骨的外科手术等。可植入人体,也可穿过皮肤对骨骼系统施加拉力(牵引力)。 | 金属锁定接骨板、金属非锁定接骨板、金属锁定接骨螺钉、金属非锁定接骨螺钉、金属股骨颈固定钉、金属接骨板钉系统、金属U型钉 | Ⅲ | 13-01-01 金属锁定接骨板 由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-2、ISO 5832-3、ISO 5832-11等标准规定的不锈钢、纯钛、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(例如钝化、电解抛光、阳极氧化等)制成,不包含全新结构设计的产品,不包括3D打印等创新工艺。适用于四肢骨折内固定。 13-01-01 金属锁定接骨螺钉 产品由符合GB 4234、ISO 5832-1标准规定的不锈钢和符合GB/T 13810、ISO 5832-2、ISO 5832-3、ISO 5832-11标准规定的纯钛、Ti6Al4V、Ti6Al4VELI、Ti6Al7Nb钛合金材料,通过常规的机械加工、热处理及表面处理工艺(例如钝化、电解抛光、阳极氧化等)制成,不包含全新结构设计的产品,不包括3D打印等创新工艺。适用于四肢骨折内固定。 13-01-01 金属接骨螺钉(非锁定) 该类产品结构参见 YY 0018,产品由符合GB 4234、ISO 5832-1标准规定的不锈钢和符合GB/T 13810、ISO 5832-2、ISO 5832-3、ISO 5832-11标准规定的纯钛、Ti6Al4V、Ti6Al4VELI、Ti6Al7Nb钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。可单独使用,适用于四肢骨折内固定。 13-01-01 空心接骨螺钉(非锁定) 该类产品由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。可单独使用,适用于四肢骨折内固定。 13-01-01 解剖型金属接骨板(非锁定) 该类产品结构参见YY 0017,由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-2、ISO 5832-3标准规定的不锈钢、纯钛、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于四肢干骺端骨折内固定。 13-01-01 直型金属接骨板(非锁定) 该类产品结构参见YY 0017,由符合GB 4234、GB/T 13810、 ISO 5832-1、ISO 5832-2、ISO 5832-3标准规定的不锈钢、纯钛、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于四肢长骨骨干骨折内固定。 13-01-01 角度型金属接骨板(非锁定) 该类产品结构参见YY 0017,由符合GB 4234、GB/T 13810、 ISO 5832-1、ISO 5832-2、ISO 5832-3标准规定的不锈钢、纯钛、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于四肢长骨骨干骨折内固定。 13-01-01 U型钉 该类产品结构参见ISO 882,由符合GB 4234、GB/T 13810、 ISO 5832-1、ISO 5832-3标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于四肢骨折内固定。 13-01-01 骨栓 该类产品由螺杆和螺母组成,由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于四肢骨折内固定。 13-01-01 金属股骨颈固定钉 该类产品结构参见YY 0346,由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于股骨颈骨折内固定。 13-01-01 外固定架配合用固定钉 该类产品由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。与外固定支架配合,适用于四肢骨折复位时部分植入人体做固定。 13-01-01 髋臼螺钉 该类产品由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-2、ISO 5832-3、ISO 5832-11、ISO 5832-12标准规定的不锈钢、纯钛、钛合金、锻造钴铬钼材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于生物型髋臼假体内固定。 13-01-01 骨缺损填充块固定螺钉 该类产品由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-2、ISO 5832-3、ISO 5832-11、ISO 5832-12标准规定的不锈钢、纯钛、钛合金、锻造钴铬钼材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于髋关节、膝关节金属骨缺损填充块的固定。 13-01-01 足踝锁定接骨板系统 该类产品由锁定接骨板和锁定接骨螺钉组成,锁定接骨板由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-2、ISO 5832-3、ISO 5832-11标准规定的不锈钢、纯钛、钛合金材料,锁定接骨螺钉由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3、ISO 5832-11标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于足踝骨折内固定。 13-01-01 手腕锁定接骨板系统 该类产品由锁定接骨板和锁定接骨螺钉组成。锁定接骨板由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-2、ISO 5832-3、ISO 5832-11标准规定的不锈钢、纯钛、钛合金材料,锁定接骨螺钉由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3、ISO 5832-11标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于手腕部骨折内固定 13-01-01 肋骨接骨板系统 该类产品由肋骨接骨板和螺钉组成。由符合GB/T 13810、ISO 5832-2、ISO 5832-3、ISO 5832-11标准规定的纯钛、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于肋骨骨折内固定。 | ||
| 02单/多部件可吸收骨固定器械 | 一般采用聚乳酸或其共聚物、复合材料等制成。 | 用于非承重部位的骨折内固定术、截骨术、关节融合术中骨折部位的固定。 | 可吸收接骨螺钉、可吸收接骨板、可吸收接骨棒、可吸收板钉系统 | Ⅲ | 同品种 | ||||
| 03单/多部件记忆合金骨固定器械 | 一般采用镍钛记忆合金材料制成,具有特定的形状。 | 利用形状记忆功能,用于骨折部位的固定。 | 记忆合金聚髌器、记忆合金肋骨板、胸骨固定器、记忆合金环抱器、张力钩、接骨器、聚髌器 | Ⅲ | 同品种 | ||||
| 04金属髓内装置 | 通常由主钉和/或附件组成,主钉通常为管状、棒状或针状。主钉和附件一般采用钛合金和不锈钢等材料制成。 | 用于骨折内固定,植入骨髓腔内由螺钉等连接固定。 | 金属髓内钉、金属带锁髓内钉、金属髓内针、金属髓内钉系统、金属带锁髓内钉系统 | Ⅲ | 13-01-04 金属带锁髓内钉 由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-2、ISO 5832-3、ISO 5832-11等标准规定的不锈钢、纯钛、钛合金材料,通过常规的机械加工、热处理及表面处理工艺制成。通常由主钉和/或附件组成,符合YY/T0727系列标准及YY/T0591标准要求,不包含全新结构设计的产品,不包括3D打印等创新工艺。适用于长骨骨折内固定。 13-01-04 金属髓内针 该类产品结构参见YY 0019,不包含带锁髓内钉。由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3标准规定的不锈钢、钛合金材料,通过常规的机械加工工艺、热处理及表面处理工艺(不包括3D打印等新技术和新工艺)制成;适用于四肢骨折内固定。植入骨髓腔内由螺钉等连接固定。 | ||||
| 05金属固定环扎装置 | 通常由金属带、金属扁平条或单股或多股金属丝组成,还可包含其他附件。一般采用纯钛及钛合金、不锈钢、钴铬钼等材料制成。 | 围绕着长骨,通过丝或螺钉锚定在该长骨上,用于骨折固定。 | 金属缆线/缆索、柔性金属丝、金属缆线/缆索系统 | Ⅲ | 13-01-05 柔性金属丝 该类产品结构参见YY/T 0816,由符合YY 0605.9、ISO 5832-1、ISO 5832-2标准规定的不锈钢、纯钛、高氮不锈钢材料,通过常规的机械加工工艺、热处理工艺(不包括3D打印等新技术和新工艺)制成。适用于四肢骨折捆扎内固定。 13-01-05 金属缆线和缆索 该类产品结构参见YY/T 0812,可含有与其配合使用的附件(如锁定针、束缚器等)。由符合GB/T 13810、YY 0605.9、ISO 5832-1、ISO 5832-2标准规定的不锈钢、纯钛、高氮不锈钢、钛合金材料,符合ASTMF1314标准规定的22Cr-13Ni-5Mn不锈钢材料、符合ISO5832-5/YY 0605.5标准规定的锻造钴铬钨镍合金材料,通过常规的机械加工、热处理工艺(不包括3D打印等创新工艺)制成。适用于四肢骨折捆扎内固定。 | ||||
| 06光面或带螺纹的金属骨固定紧固件 | 通常由一段刚性丝或棒组成。一般采用钛合金、钴铬钼或不锈钢等材料制成。可以是直型或U型,端部可以是锋利(钝)且可能有加工成型的带槽的头。 | 用于骨折固定、骨重建,作为插入其他植入物的导针,也可穿过皮肤植入人体对骨骼系统施加拉力(牵引力)。 | 金属骨针 | Ⅲ | 13-01-06 金属骨针 该类产品包括克氏针和斯氏针,结构参见YY 0345。由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3标准规定的不锈钢、钛合金材料,符合ISO 5832-5标准规定的锻造钴铬钨镍材料通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于四肢骨折复位时部分植入人体做牵引、配合外固定支架进行四肢骨折固定或单独植入用于四肢骨折内固定。 | ||||
| 02 | 运动损伤软组织修复重建及置换植入物 | 01运动损伤软组织修复重建植入物 | 通常为钩状、钉状、门型、板状植入物,或与可植入缝线共同使用。一般采用金属、高分子、复合材料等制成,附着在固定装置上的缝线分为可吸收,部分可吸收和不可吸收三大类。 | 用于肩、足、踝、髋、膝、手、腕、肘、半月板、交叉韧带等部位的软组织重建和修复。 | 带线锚钉、界面螺钉(干预螺钉)、门型钉、半月板缝合钉、带线固定板 | Ⅲ | 13-02-01 不可吸收带线锚钉 该类产品由锚钉和缝线组成,可带缝合针。锚钉由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3、ISO 5832-11标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。缝线可由聚乙烯、聚丙烯、聚酯、聚酰胺等不可吸收材料制成,性能指标符合YY0167标准规定的适用部分。缝合针应符合YY0166和YY0043的要求。该产品可预装插入器,插入器与人体接触部分通常由符合YY/T 0294、ASTM F899或YY/T 0726规定的不锈钢材料制成。适用于骨与软组织的连接固定。 13-02-01 不可吸收韧带固定螺钉 该类产品由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于韧带的修复和重建。 13-02-01 带袢钛板 产品由钛板、线圈和缝线组成。钛板应由符合GB/T 13810、ISO 5832-3标准规定的Ti6Al4V、Ti6Al4VELI钛合金制成,线圈和缝线材质为高分子材料,如聚对苯二甲酸乙二酯,聚丙烯、聚乙烯,聚酯材料。适用于骨科重建术中韧带或肌腱与骨的固定。 | ||
| 02运动损伤软组织置换植入物 | 一般采用高分子材料或同种异体组织制成。用于全部或部分地置换损伤组织。 | 用于补偿天然组织的损伤。 | 人工韧带 | Ⅲ | 临床试验 | ||||
| 03 | 脊柱植入物 | 01脊柱椎板间固定系统 | 通常由多种钩、连接杆、植入板、螺钉、螺塞、垫片、连接器等部件组成。一般采用不锈钢、纯钛、钛合金等材料制成。通常贯穿3块相邻的椎骨,拉直并固定脊柱使椎骨能够与植入物连接并融合在一起。 | 用于治疗脊柱侧凸,也可用于治疗脊柱的骨折和脱位、重度腰椎滑脱(3、4级)以及下背部综合征,或脊柱椎管扩大减压术后的椎板成形等。 | 颈椎后路非椎弓根固定系统、胸腰椎后路非椎弓根脊柱固定系统、枕颈系统、椎板固定板系统 | Ⅲ | 13-03-01 椎板固定板系统 该类产品由固定板和螺钉组成,固定板由符合GB/T 13810 、ISO 5832-2 、ISO 5832-3标准规定的纯钛、钛合金材料,螺钉由符合GB/T 13810 、ISO 5832-3标准规定的钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D 打印等创新工艺)制成。适用于脊柱椎管扩大减压术后的椎板成形。 | ||
| 02脊柱椎体间固定/置换系统 | 通常由多种骨板和连接螺钉等组成。一般采用纯钛、钛合金等材料制成,特殊产品也可采用聚乳酸或其共聚物等材料制成。 | 金属植入物用于治疗脊柱侧凸,也可用于脊柱前路椎体固定,或用于椎体置换等。可吸收植入物用于与传统坚强内固定器械配合使用,在脊柱椎体切除融合术中辅助植骨。 | 颈椎前路固定系统、胸腰椎前路固定系统、可吸收颈椎前路钉板系统、椎体置换系统 | Ⅲ | 同品种 | ||||
| 03脊柱椎弓根系统 | 通常由螺栓、钩、螺钉、连接装置、连接棒、连接杆、横向连接器等多个组件组成。一般采用钛合金、纯钛、钴铬钼、聚醚醚酮等材料制成。可用于固定脊柱节段。 | 用于治疗胸腰椎、骶骨脊柱畸形脊柱滑脱,退行性腰椎滑脱,椎骨骨折、脱位,脊柱侧凸,脊柱后凸,脊柱肿瘤,融合失败等。 | 颈椎椎弓根系统、胸腰椎椎弓根系统 | Ⅲ | 同品种 | ||||
| 04椎间融合器 | 通常由单个或多个部件组成。一般采用金属、高分子或复合材料制成。可植入颈椎或腰骶的椎体间隙中或用于胸腰椎椎体置换及恢复椎体病变受损而丢失的高度。 | 用于患有椎间盘退行性疾病、椎体滑脱、椎体不稳等病症的骨骼成熟患者,在一个或两个相邻椎体节段上进行融合。 | 颈椎椎间融合器、胸腰椎椎间融合器 | Ⅲ | 同品种 | ||||
| 05椎间盘假体 | 通常由上、下终板和髓核组成。终板一般采用钴基合金、钛合金等材料制成,两面可带有涂层;髓核一般采用超高分子量聚乙烯、陶瓷等材料制成。可植入椎体间置换人体椎间盘。 | 用于椎间盘置换术,以恢复椎体相邻节段间的支撑和相对运动。 | 颈椎椎间盘假体、胸腰椎椎间盘假体 | Ⅲ | 临床试验 | ||||
| 06棘突植入物 | 通常由单个或多个部件组成。一般采用钛合金等材料制成。该产品可用于在腰椎棘突间施加一定的撑开力,限制腰椎过度后伸。 | 用于维持腰椎活动节段棘突间的稳定。 | 棘突间植入物 | Ⅲ | 同品种 | ||||
| 04 | 关节置换植入物 | 01髋关节假体 | 通常由髋臼部件和股骨部件组成。一般采用钛合金、钴铬钼、不锈钢、超高分子量聚乙烯、陶瓷等材料制成。根据人体髋关节的形态、构造及功能设计,替换髋关节的一个或两个关节面,通过关节面的几何形状来限制其在一个或多个平面内的平移和旋转。 | 用于外科手术植入人体,代替患病髋关节,达到缓解髋关节疼痛,恢复髋关节功能的目的。 | 髋关节假体系统、髋关节假体、髋臼假体、髋关节股骨假体 | Ⅲ | 同品种 | ||
| 骨水泥型髋关节假体置换术用配件 | 在骨水泥型髋关节置换术中作为配件使用 | 中置器、远端塞、髋臼杯用孔塞、髓腔塞 | Ⅲ | 13-11 中置器 该类产品由PMMA、符合GB/T19701.2标准规定的超高分子量聚乙烯材料制造。适用于骨水泥型髋关节置换手术中保持股骨柄远端中置,阻隔骨水泥并确保骨水泥在假体周围的均匀分布。 13-11 远端塞 该类产品由PMMA、符合GB/T19701.2标准规定的超高分子量聚乙烯材料制造。适用于骨水泥型髋关节置换术中,阻隔骨水泥。 13-11 髋臼杯用孔塞 产品由符合GB/T 13810、ISO 5832-3标准Ti6Al4V钛合金制成。配合髋臼杯使用,用于髋臼杯产品孔的填塞。 13-11 髓腔塞 产品由符合GB/T 19701.2、ISO 5834-2标准规定的超高分子量聚乙烯材料制造。用于骨水泥型假体植入手术,作用为防止骨水泥溢入髓腔限制区域,适用部位为股骨、胫骨和肱骨的髓腔。 | |||||
| 02膝关节假体 | 通常由股骨部件、胫骨部件和髌骨部件组成。一般采用钛合金、钴铬钼、超高分子量聚乙烯等材料制成。根据人体膝关节的形态、构造及功能设计,替代膝关节的一个、两个或三个间室的关节面。 | 用于外科手术植入人体,代替患病膝关节,达到缓解膝关节疼痛,恢复膝关节功能的目的。 | 膝关节假体系统、膝关节假体、膝关节股胫假体、膝关节髌股假体、膝关节髌股胫假体、膝关节股骨假体、膝关节髌骨假体、膝关节胫骨假体 | Ⅲ | 同品种 | ||||
| 03肩关节假体 | 通常由肱骨部件和关节窝部件组成。一般采用钛合金、钴铬钼、超高分子量聚乙烯等材料制成。根据人体肩关节的形态、构造及功能设计,替代肩关节的关节面。 | 用于外科手术植入人体,代替患病肩关节,达到缓解肩关节疼痛,恢复肩关节功能的目的。 | 肩关节假体系统、肩关节假体、肩关节肩盂假体、肩关节肱骨假体 | Ⅲ | 同品种 | ||||
| 04肘关节假体 | 通常由肱骨部件和桡骨部件组成。一般采用钛合金、钴铬钼、超高分子量聚乙烯等材料制成。根据人体肘关节的形态、构造及功能设计,替代肘关节的关节面。 | 用于外科手术植入人体,代替患病肘关节,达到缓解肘关节疼痛,恢复肘关节功能的目的。 | 肘关节假体系统、肘关节假体、肘关节径向假体、肘关节肱骨假体 | Ⅲ | 同品种 | ||||
| 05 | 骨科填充和修复材料 | 01丙烯酸树脂骨水泥 | 通常由粉体和液体组成。一般采用甲基丙烯酸甲酯、聚甲基丙烯酸甲酯、丙烯酸酯或聚甲基丙烯酸甲酯和聚苯乙烯共聚物等材料制成。粉体和液体一般经混合搅拌后使用。 | 用于关节成形术、脊柱或创伤手术中金属或高分子植入物与活体骨的固定。也可用于椎体的填充;固定椎体的骨缺损或与内固定产品一同用于上肢、下肢或骨盆的骨质疏松性骨折治疗。 | 丙烯酸树脂骨水泥 | Ⅲ | 同品种 | ||
| 03 同种异体骨修复材料 | 通常由同种异体骨经过加工制备而成。不含活细胞成分。 | 用于骨缺损、骨不连、骨延迟愈合或不愈合的填充修复,以及脊柱融合、关节融合及矫形植骨修复。 | 同种异体骨修复材料 | Ⅲ | 同品种 | ||||
| 04 金属填充物 | 一般采用钽金属、钛或钛合金等材料制成,具有多孔结构或粗糙表面。根据使用部位的不同,具有特定形状。 | 用于重建由于严重退化、创伤或其它病理改变造成的髋关节、膝关节骨缺损;或用于翻修、补救既往关节重建术和植入物失效时的骨缺损;或用于治疗未发生股骨头塌陷的股骨头坏死。 | 填充块 | Ⅲ | 13-05-04 填充棒/填充块 产品由符合ISO 13782标准规定的纯钽制成(不包括3D打印等创新工艺制备产品)。产品单独使用,用于四肢骨填充。 | ||||
| 06 | 神经内/外科植入物 | 01单/多部件预制颅骨成形术板及紧固件 | 通常由板及紧固件组成。一般采用纯钛、钛合金、钴铬合金等金属材料以及可吸收或不可吸收高分子材料制成。其中板通过紧固装置(如螺钉、金属丝或其它组件)固定就位。 | 用于修补、覆盖、填充或固定颅骨缺损或孔洞。 | 预制颅骨板系统、可塑形预制颅骨板系统、钛网、钛网板系统 | Ⅲ | 同品种 | ||
| 02颅骨夹/锁 | 通常由单个或多个部件组成。一般采用钛合金等金属材料以及可吸收或不可吸收高分子材料制成。 | 用于开颅手术后颅骨瓣的固定。 | 颅骨夹、颅骨锁 | Ⅲ | 同品种 | ||||
| 03单/多部件颅颌面固定器械及附件 | 通常由一个或多个部件及紧固件组成。一般采用纯钛、钛合金等金属材料以及可吸收或不可吸收高分子材料制成。其中板通过紧固装置(如螺钉或其它组件)固定就位。 | 用于神经外科和颌面外科手术中骨折的固定。 | 颅颌面内固定系统、颅颌面板钉系统 | Ⅲ | 13-06-03 头钉 产品通常由主体、基座、O形环、橡胶帽组件组合而成,其中仅主体与人体接触。主体应使用GB 4234、ISO 5832-1、ASTM F899标准规定的不锈钢或ISO 5832-3、GB/T 13810标准规定的Ti6Al4V、Ti6Al4VELI钛合金材料制成,产品与颅骨固定器配合使用,在头骨需要重度修复的外科手术过程中将患者的头部与颈部固定在特定的位置。该产品为非植入物,仅在术中使用,与人体短期接触,术后即刻拆除。 13-06-03 颅颌面接骨板系统 由符合GB 4234.1、GB/T 13810、ISO 5832-1、ISO 5832-2、ISO 5832-3标准规定的不锈钢、纯钛、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成,不包含全新结构设计的产品。适用于颅颌面骨折内固定。修补、覆盖、填充骨缺损或孔洞者除外。 | ||||
| 05动脉瘤夹 | 通常由单个部件组成。一般采用钛合金等金属材料制成。用于使颅内动脉瘤颈或囊闭塞的装置。 | 用于颅内动脉瘤瘤颈或瘤体的永久性闭塞治疗。 | 动脉瘤夹、脑动脉瘤夹 | Ⅲ | 13-06-05 动脉瘤夹 一般采用钛合金等金属材料制成。用于使颅内动脉瘤颈或囊闭塞的装置。用于颅内动脉瘤瘤颈或瘤体的永久性闭塞治疗,也可用于动静脉畸形小血管或动静脉瘘的永久性闭塞治疗。产品与已获准境内注册产品具有等同性,产品组成材料成熟。新型结构设计、新型作用机理、药械组合产品除外。 | ||||
| 06颅内支架系统 | 通常由支架和/或输送系统组成。支架一般采用金属材料制成,可覆高分子材料制成的膜。经腔放置的植入物,扩张后通过提供一个机械性的支撑,以维持或恢复颅内血管的通畅性,或辅助弹簧圈治疗出血性病变。 | 用于治疗颅内、颅底动脉血管狭窄或辅助弹簧圈治疗颅内动脉瘤等其他出血性病变。 | 颅内支架 | Ⅲ | 临床试验 | ||||
| 08颅内弹簧圈系统 | 通常由弹簧圈和输送导丝组成。弹簧圈的绕丝一般采用铂钨、铂铱合金等金属材料制成,芯丝一般采用聚丙烯等高分子材料制成,部分弹簧圈表面可能含有聚酯纤维等高分子材料的纤毛。弹簧圈植入颅内可阻断异常血流。 | 用于在神经颅内手术中治疗颅内动脉瘤及其他神经血管异常的栓塞。 | 颅内弹簧圈 | Ⅲ | 同品种 | ||||
| 09人工颅骨 | 一般采用硅橡胶与涤纶网膜材料复合而成,也可采用聚醚醚酮、钛合金等材料制成。 | 用于缺损颅骨的替代或重建。 | 人工颅骨 | Ⅲ | 同品种 | ||||
| 11颅内动脉瘤血流导向装置 | 通常由编织植入物和输送系统组成。编织植入物一般选用钴铬合金和铂钨合金材料制成,输送导丝一般为不锈钢材料制成。由多股金属丝编织而成的植入物采用密网设计可以限制血流继续进入动脉瘤体,从而使动脉瘤内血流停滞,直至瘤体逐渐缩小。 | 用于血管腔内治疗成人颈内动脉岩段至垂体上动脉开口处近端的大或巨大宽颈动脉瘤。 | 颅内动脉瘤血流导向装置 | Ⅲ | 临床试验 | ||||
| 07 | 心血管植入物 | 01血管内假体 | 通常由假体和/或输送系统组成。假体通常由移植物(覆膜)和支撑结构组成,移植物一般采用高分子材料制成。支撑结构一般采用金属材料制成,支撑结构通过缝合或嵌入的方式固定在移植物上。血管内假体一端可设计为锚定结构,以增强假体的固定能力。通过将血管内假体部分或全部置于血管管腔内,对患者的自体血管或人工血管进行修复、替换或者建立旁路血管通道。 | 用于治疗动脉瘤、动脉夹层等血管病变。 | 胸主动脉覆膜支架、腹主动脉覆膜支架、术中支架 | Ⅲ | 临床试验 | ||
| 02血管支架 | 通常由支架和/或输送系统组成。支架一般采用金属或高分子材料制成,其结构一般呈网架状。经腔放置的植入物扩张后通过提供机械性的支撑,以维持或恢复血管管腔的完整性,保持血管管腔通畅。支架可含或不含表面改性物质(不含药物),如涂层。为了某些特殊用途,支架可能有覆膜结构。 | 用于治疗动脉粥样硬化、以及各种狭窄性、阻塞性或闭塞性等血管病变。 | 冠状动脉支架、外周动脉支架、肝内门体静脉支架 | Ⅲ | 临床试验 | ||||
| 通常由支架和/或输送系统组成。支架一般采用金属或高分子材料制成,其结构一般呈网架状。经腔放置的植入物扩张后通过提供机械性的支撑,以维持或恢复血管管腔的完整性,保持血管管腔通畅。支架可含或不含表面改性物质,如涂层。为了某些特殊用途,支架可能有覆膜结构。含有药物成分。 | 用于治疗动脉粥样硬化、以及各种狭窄性、阻塞性或闭塞性等血管病变。 | 药物洗脱冠状动脉支架、药物洗脱外周动脉支架 | Ⅲ(药械组合产品) | 临床试验 | |||||
| 03腔静脉滤器 | 通常由腔静脉滤器和/或输送系统组成。腔静脉滤器一般采用金属材料制成。经腔放置的植入物扩张后通过机械过滤的方式来预防肺栓塞。 | 用于机械过滤下腔静脉来预防肺栓塞。 | 永久腔静脉滤器、可回收腔静脉滤器、可转换回收腔静脉滤器 | Ⅲ | 临床试验 | ||||
| 04人工血管 | 一般采用完全或部分的生物材料、合成编织型材料、合成非编织型材料制成。 | 用于置换血管、在血管间旁路移植或形成分流。 | 人工血管 | Ⅲ | 临床试验 | ||||
| 06人工心脏瓣膜及瓣膜修复器械 | 一般采用高分子材料、动物组织、金属材料制成,可含或不含表面改性物质。 | 用于替代或修复天然心脏瓣膜(如主动脉瓣、二尖瓣、肺动脉瓣及三尖瓣)。 | 外科生物心脏瓣膜、外科机械心脏瓣膜、经导管植入式心脏瓣膜、心脏瓣膜成形环 | Ⅲ | 临床试验 | ||||
| 07心脏封堵器 | 通常由封堵器和/或输送系统组成。封堵器的网状或伞状结构一般采用金属材料制成,其余部分一般采用高分子材料制成,放置于心脏缺损、异常通路或特殊开口等处,并封堵该位置,达到阻止异常血流流通的目的。 | 用于治疗先天性心房间隔缺损、心室间隔缺损和动脉导管未闭、卵圆孔未闭等疾病。 | 房间隔缺损封堵器、室间隔缺损封堵器、动脉导管未闭封堵器、左心耳封堵器 | Ⅲ | 临床试验 | ||||
| 08 | 耳鼻喉植入物 | 01听小骨假体 | 一般采用铂金属、不锈钢、纯钛或钛合金等金属材料制成,亦有产品采用羟基磷灰石制成。 | 用于传导性耳聋,对全部或部分听小骨链施行置换手术。 | 生物陶瓷听小骨置换假体、听小骨假体 | Ⅲ | 同品种 | ||
| 02耳内假体 | 一般采用不锈钢、钛合金等金属材料和/或聚四氟乙烯等高分子材料制成。 | 用于植入耳内,以重建声音传导链或治疗镫骨不能移动的耳硬化症,也可用于预防中耳积液。 | 通风管 | Ⅲ | 同品种 | ||||
| 09 | 整形及普通外科植入物 | 02整形用注射填充物 | 通常由注射器以及预装在注射器中的填充材料组成。 | 用于注射到真皮层和/或皮下组织,以填充增加组织容积。 | 注射用交联透明质酸钠凝胶、注射用透明质酸钠凝胶、胶原蛋白植入剂、注射用聚左旋乳酸填充剂 | Ⅲ | 临床试验 | ||
| 03乳房植入物 | 通常由外壳和壳内填充物组成。植入体外壳一般采用多层医用硅橡胶制成,壳内充有医用级硅凝胶等材料。 | 用于隆乳和乳房再造。 | 人工乳房植入体、乳房植入体、硅凝胶填充乳房植入体 | Ⅲ | 临床试验 | ||||
| 04外科补片/外科修补网 | 一般采用一种或多种合成高分子生物材料或天然高分子生物材料制成。 | 用于植入人体,加强和修补不完整的腹壁和/或腹股沟区等软组织的缺损。 | 疝气补片、外科修复补片、外科修复网、疝修补补片 | Ⅲ | 13-09-04 外科疝修补补片 腹腔外置疝补片:植入体内的补片(如平片、网塞等),由聚丙烯、聚对苯二甲酸乙二醇酯或聚偏二氟乙烯材料制成,可带有部分可吸收材料,用于腹腔外对疝与腹壁缺损进行修补;腹腔内置疝修补补片:腹壁侧由聚丙烯、聚对苯二甲酸乙二醇酯或聚偏二氟乙烯材料制成,腹腔侧由可降低粘连的材料制成,用于腹腔内对疝与腹壁缺损进行修补。上述两类补片与已获准境内注册产品具有等同性,组成材料成熟,可降低粘连的材料在上市同类产品中已应用。新型结构设计、新型作用机理、药械组合产品除外。不包括最终全部吸收的产品及以自体组织重建实现修复的产品。 | ||||
| 05修补固定器 | 通常由缝钉和置入装置(器械杆、手柄、击发扳机)组成。 | 在多种微创及开放外科手术(如疝修补术)中,用于固定对软组织进行修补的材料。 | 可吸收钉修补固定器、可吸收夹固定装置、固定夹 | Ⅲ | 同品种 | ||||
| 06非血管支架 | 通常由支架和/或输送系统组成。支架一般采用金属材料制成,可覆高分子材料制成的膜。经腔放置的植入物扩张后通过提供机械性的支撑,以维持或恢复腔道的完整性。 | 用于预防非血管腔道的狭窄或重建腔道的结构和/或功能,也可用于胆汁/胰液的内引流。 | 胆道支架、尿道支架、肠道支架、气管支架、食道支架、前列腺尿道支架、胰管支架、十二指肠支架、结肠支架、幽门支架、气管造口支架系统、鼻窦支架 | Ⅲ | 13-09-06 胆道/胰管/输尿管支架 支架由不可降解/吸收的高分子材料(如聚乙烯、聚氨酯等)制成管状结构,可带有不透射线标记等组件,可涂有涂层,可包含输送器组件。用于在内窥镜下植入腔道,扩张植入部位的狭窄,进行引流。与已获准境内注册产品具有等同性。产品组成材料成熟,新型结构设计、新型作用机理、药械组合产品除外。 13-09-06 非血管自扩张金属支架 支架由具有形状记忆性能的金属(如镍钛合金等)制成,可带有不透射线标记,可有/无覆膜,可包含输送器组件。用于扩张食道、胆道、气道、肠道等非血管部位的狭窄。与已获准境内注册产品具有等同性。产品组成材料成熟,新型结构设计、新型作用机理、药械组合产品除外。 | ||||
| 07支气管内活瓣 | 通常由活瓣、输送导管、装载器和气道定径套件(玻璃注射器、活塞和量规)组成。活瓣支撑架一般采用镍钛合金制成,覆有聚氨酯膜。 | 用于控制气流以改善病变分布不均匀的肺气肿患者的肺功能及减少漏气。 | 支气管内活瓣 | Ⅲ | 临床试验 | ||||
| 10 软组织扩张器 | 一般由扩张器壳体、导管、注射座及连接管组成,其中注射阀由硅橡胶和不锈钢碗组成。 | 用于获取自体皮肤组织以解决皮肤供区不足,也可用于头皮缺损、秃发再造、耳鼻再造和各类疤痕的修补。 | 软组织扩张器 | Ⅲ | 13-09-10 组织扩张器 一般由壳体、导管、注射座(或起相同作用的组件)和连接器(如果有)等组成。壳体的主要材料为硅橡胶。作用原理为可填充盐水以增大自身体积对组织进行扩张。用于获取自体皮肤组织以解决皮肤供区不足,手术中使用或植入6个月内取出。与已获准境内注册产品具有等同性。新型结构设计、药械组合产品除外。 | ||||
| 10 | 组织工程支架材料 | 01脱细胞皮肤 | 通常由异种或同种异体皮肤组织经一系列处理后制成,包括真皮层及表皮层,其主要成分为胶原蛋白。不含活细胞成分。 | 用于皮肤缺损创面的修复,引导患者皮肤组织的修复和再生。 | 脱细胞猪皮、脱细胞异体皮肤 | Ⅲ | 临床试验 | ||
| 02脱细胞真皮基质 | 通常由异种或同种异体皮肤组织经一系列处理后制备的脱细胞真皮基质制成,其主要成分为胶原蛋白。不含活细胞成分。 | 用于真皮层缺损的创面修复,引导患者皮肤组织缺损的修复和再生。 | 猪皮脱细胞真皮基质、脱细胞异体真皮基质 | Ⅲ | 临床试验 | ||||
| 03 胶原蛋白支架材料 | 通常为胶原蛋白。不含活细胞成分。 | 用于皮肤、真皮的修复和再生。 | 医用胶原修复膜 | Ⅲ | 临床试验 | ||||
| 04神经修复材料 | 通常由异种或同种异体的神经或肌腱组织经脱细胞处理后获得的细胞外基质制成。或者由人工合成高分子材料或天然高分子材料制成。不含活细胞成分。 | 用于修复各种原因所致的外伤性神经缺损。 | 脱细胞同种异体神经修复材料、脱细胞人工神经鞘管、聚乳酸人工神经管、神经套管 | Ⅲ | 临床试验(生物型) | ||||
| 05 含重组人骨形态发生蛋白质的骨修复材料 | 通常在异种骨、同种异体骨、胶原、无机钙盐类材料、可吸收高分子材料中的一种或两种以上的复合材料中加入骨形态发生蛋白质-2(BMP-2)。 | 用于骨缺损、骨不连、骨延迟愈合或不愈合的填充修复,以及脊柱融合、关节融合及矫形植骨修复。 | 含蛋白质-2(rhBMP-2)的骨修复材料、含蛋白质-2(rhBMP-2)的胶原基骨修复材料 | Ⅲ(药械组合产品) | 临床试验 | ||||
| 11 | 其他 | 02漏斗胸成形系统 | 通常由肋骨成形板、固定片、固定杆等部件组成。一般由纯钛、钛合金或不锈钢等材料制成。 | 用于漏斗胸和其他胸骨畸形成形术中的内固定。 | 漏斗胸成形系统、纵向胸廓成形人工钛肋系统 | Ⅲ | 同品种 | ||
| 03 胸骨捆扎/抓扣固定系统 | 通常由结扎带和穿引弯钩两部分组成,其中穿引弯钩非植入人体,仅用于辅助结扎带穿引安装,安装后废弃。也可由上下片及螺钉组成。也可由带或不带夹子的捆绑钢缆、粗隆爪、钢缆钉、钢缆螺丝钉、钢板组成。 | 用于开胸术中的胸骨固定。器械可单独使用,也可与其它传统不锈钢丝配合使用。 | 胸骨结扎带 | Ⅲ | 13-11-03 胸骨结扎带 产品由符合GB/T 13810、ISO 5832-3、ISO 5832-11、ISO 5832-1标准规定的Ti6Al4V、Ti6Al4VELI、Ti6Al7Nb钛合金材料、不锈钢材料制成,穿引弯钩也可由符合ASTM F899标准规定的材料制成,产品通常由结扎带和穿引弯钩两部分组成,其中穿引弯钩非植入人体,仅用于辅助结扎带穿引安装,安装后废弃。用于开胸术中的胸骨固定。不包含全新结构设计的产品。 | ||||
