一、医疗器械注册情况
(一)医疗器械行政受理情况2020 年,全国共完成第一类医疗器械备案 35984 件;其中,境内第一类医疗器械备案 35057 件,进口第一类医疗器械(含港澳台)备案 927 件。全国共受理医疗器械首次注册申请 20654 件;其中,受理境内第二类医疗器械首次注册申请 18697 件,受理境内第三类医疗器械首次注册申请 1287 件,受理进口医疗器械(含港澳台)首次注册申请 670 件。全国共受理医疗器械延续注册申请 16619 件;其中,境内第二类延续注册医疗器械 10688 件,境内第三类延续注 册医疗器械 2165 件,进口延续注册医疗器械(含港澳台)3766 件。 全国共受理医疗器械许可事项变更申请 9614 件;其中,境内第二类医疗器械 6932 件,境内第三类医疗器械 768 件,进口医疗器械(含 港澳台)1914 件。全国共受理医疗器械登记事项变更申请 12500 件; 其中,境内第二类医疗器械 7923 件,境内第三类医疗器械 2114 件, 进口医疗器械(含港澳台)2463 件。详见附表 33。
(二)医疗器械产品注册情况2020 年,全国共批准各类医疗器械首次注册 15208 件;延续注册 14618 件;许可事项变更 9095 件。其中,境内第二类医疗器械首次注册 13636 件,境内第三类医疗器械首次注册 1020 件,进口医疗器械(含港澳台)首次注册 552 件;批准境内第二类医疗器械延续注册 9099 件,境内第三类医疗器械延续注册 1815 件,进口医疗器械(含港澳台)延续注册 3704 件;批准境内第二类医疗器械许可事项变更 6446 件,境内第三类医疗器械许可事项变更 712 件,进口医疗器械(含港澳台)许可事项变更 1937 件。截至 2020 年底,全国累计共有境内第一类医疗器械备案 100074 件,进口第一类医疗器械(含港澳台)备案 7913 件;各省级局共批准境内第二类医疗器械注 册 68917 件。详见附表 33、34。
二、医疗器械标准制修订情况
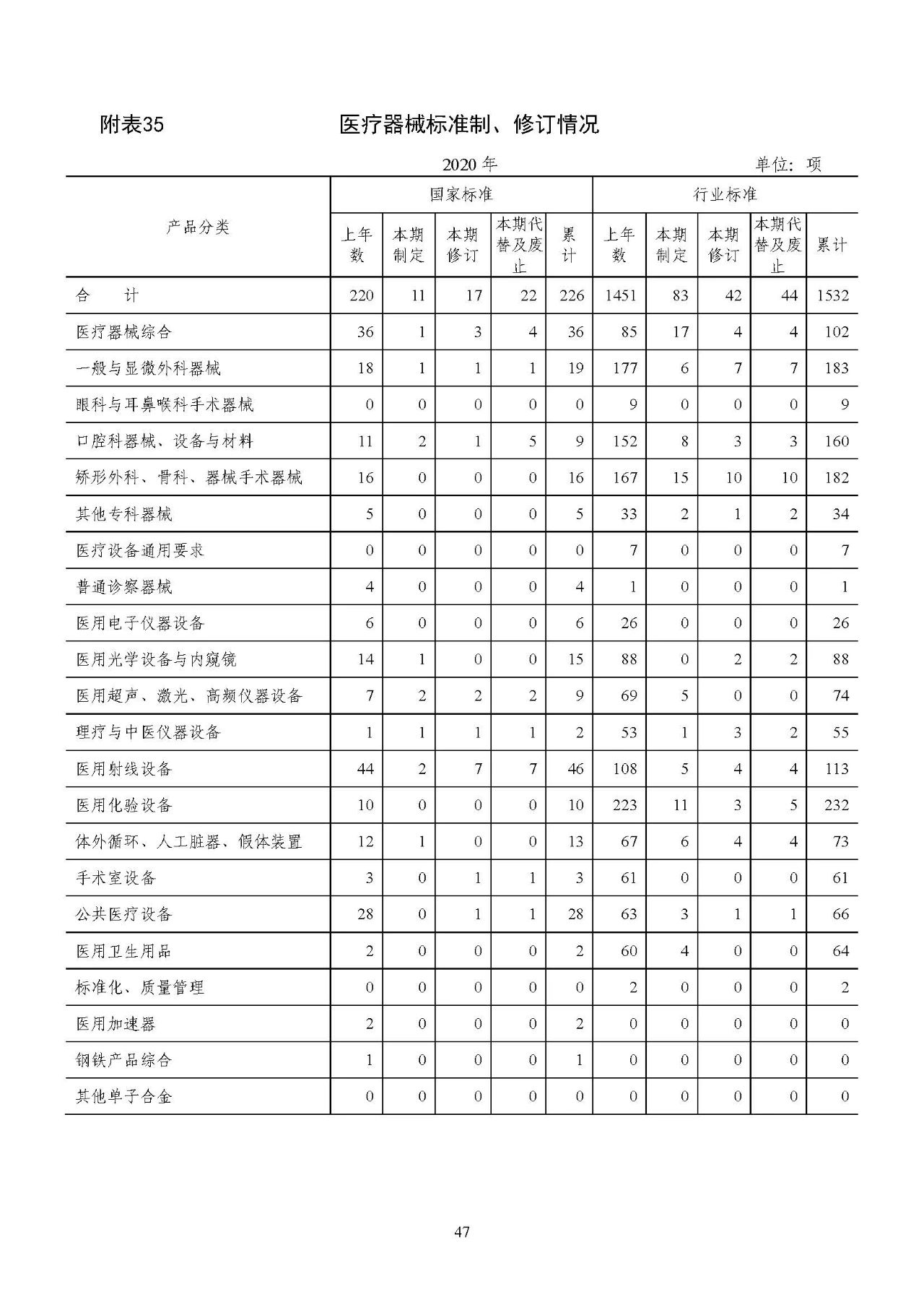
2020 年医疗器械国家标准制、修订工作中,制定 11 项,修订17 项,代替及废止国家标准 22 项;行业标准制、修订工作中,制定 83 项,修订 42 项,代替及废止行业标准 44 项。截至 2020 年底,我国共有医疗器械标准 1758 项,其中国家标准 226 项,行业标准1532 项。详见附表 35。
三、医疗器械生产企业情况
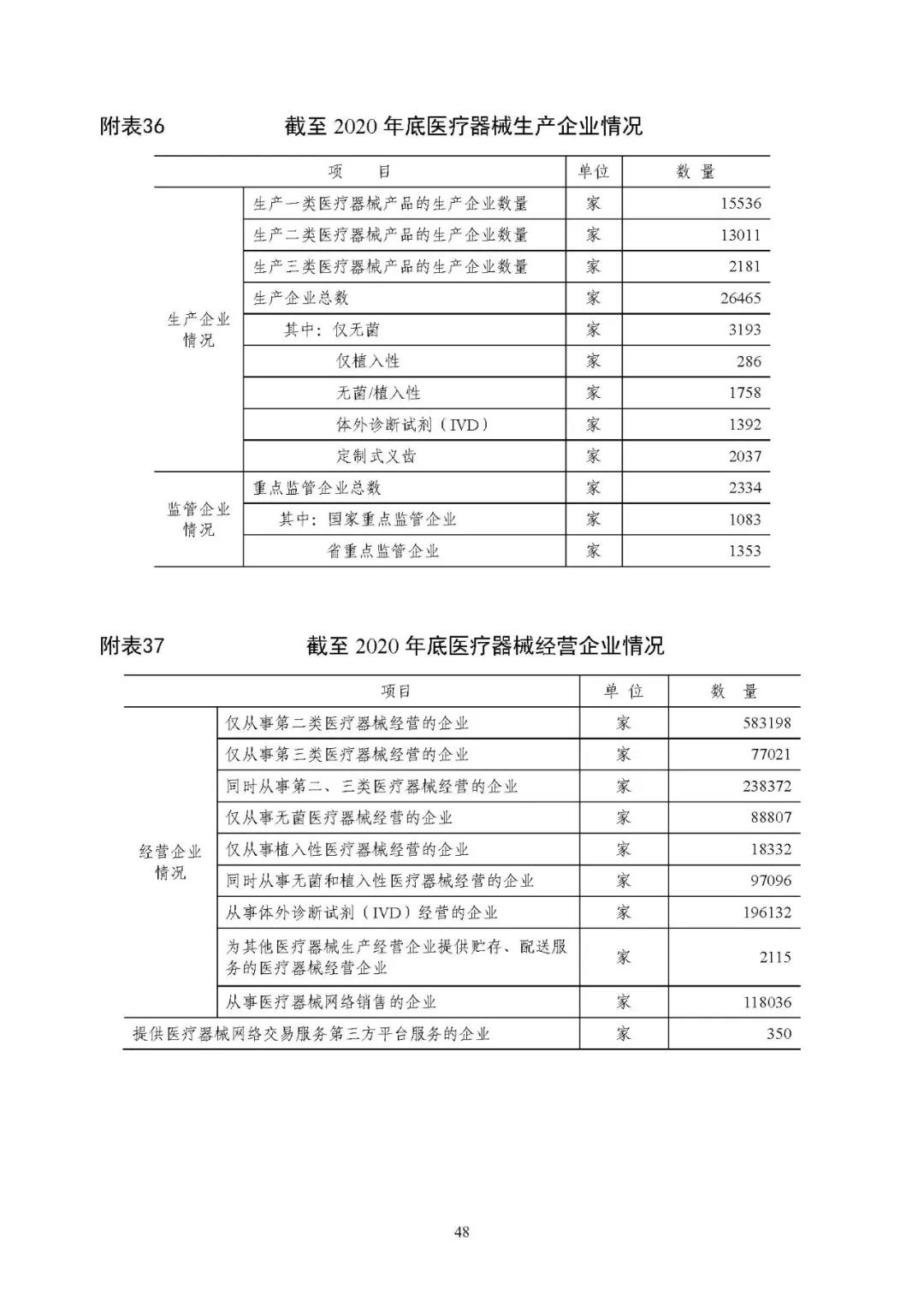
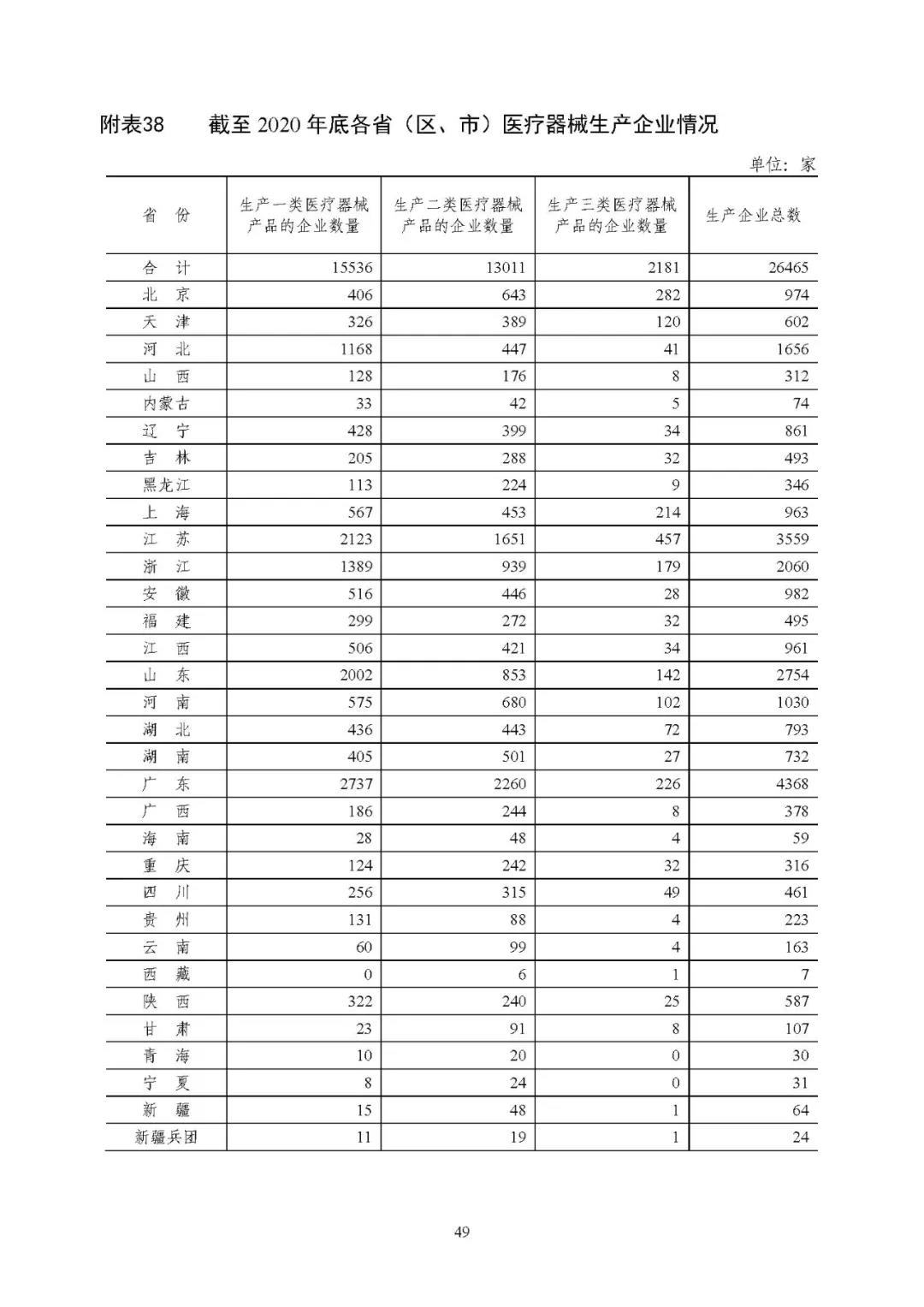
截至 2020 年底,全国实有医疗器械生产企业 2.65 万家,其中(同时生产一类、二类或三类产品的企业,统计时分别计为一类生产企业、二类生产企业和三类生产企业,企业总数仅计一家):可生产一类产品的企业 1.55 万家,可生产二类产品的企业 1.30 万家, 可生产三类产品的企业 2181 家。详见附表 36、38。
四、医疗器械经营企业情况
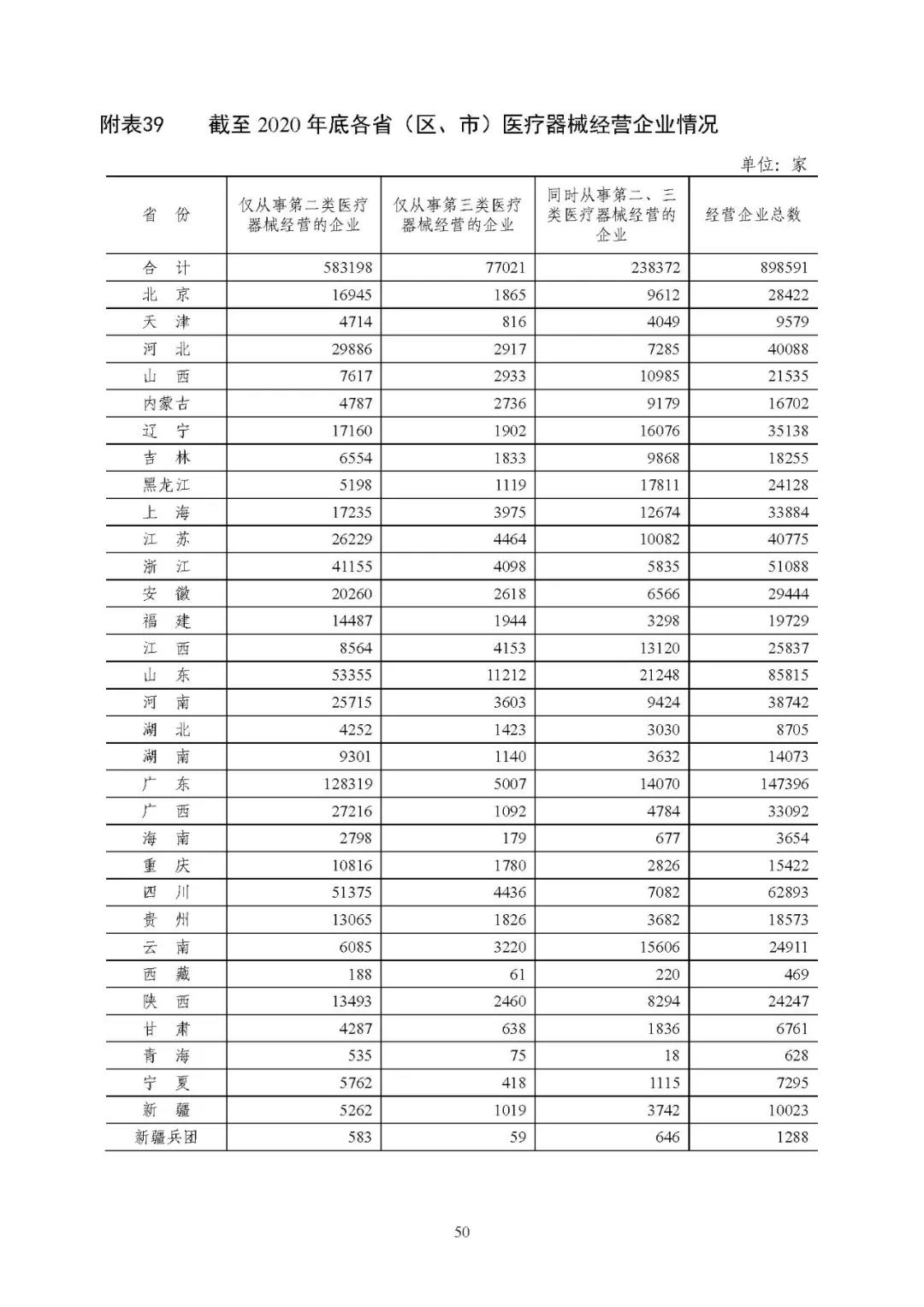
截至 2020 年底,全国共有二、三类医疗器械经营企业 89.86 万家,其中,仅经营二类医疗器械产品的企业 58.32 万家,仅经营三类医疗器械产品的企业 7.70 万家,同时从事二、三类医疗器械经营的企业 23.84 万家。详见附表 37、39。
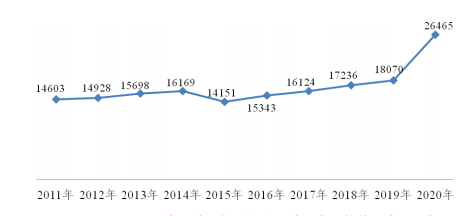
图 2-1 2011-2020 年医疗器械生产企业数量变化趋势 单位:家
五、医疗器械日常监管情况
(一)医疗器械生产企业日常监管情况 2020 年各级监管机构共检查医疗器械生产企业 4.25 万家次。检查国家重点监管企业 2041 家次。全面检查高风险企业无菌医疗器械生产企业 1.03 万家次,其中未通过检查 334 家次,未通过率 3.23%;检查植入性医疗器械生产企业 927 家次,未通过检查 8 家次,未通 过率 0.86%;检查第三类医疗器械生产企业 3924 家次,未通过检查 63 家次,未通过率 1.61%。详见附表 40。(二)医疗器械经营企业日常监管情况 2020 年各级监管机构共检查医疗器械经营企业、使用单位259.73 万家次,其中检查经营企业 176.72 万家次,发现存在违法违规行为的企业 3.51 万家次,完成整改 4.49 万家次,立案查处 7208家次。检查使用单位 82.21 万家次,发现存在违法违规行为的使用单位 2.29 万家次,完成整改 2.61 万家次,立案查处 6768 家次。省及省以下监管机构共检查医疗器械网络交易第三方平台 7999 家次,发现存在违法违规行为的 169 家次,完成整改 263 家次,立案查处28 家次。移交卫生部门处理 125 家次。详见附表 41。
六、地方医疗器械抽验情况
2020 年各省(区、市)共检验医疗器械 2.20 万批次,不合格1857 批次,不合格率 8.45%。详见附表 42。七、医疗器械不良事件监测情况
2020年国家药品不良反应监测中心共收到医疗器械不良事件报告 53.61 万份,其中严重伤害事件报告 3.29 万份;死亡事件报告 218份,涉及 88 个产品品种,其中,上海在 2020 年报告了 164 份死亡 事件。详见附表 43。八、医疗器械案件查处情况
2020 年查处医疗器械案件 2.67 万件,同比增加 73.65%,货值金额 3.83 亿元,同比增加 252.37%。查处医疗器械案件数量前 5 位 的省份为:河南、河北、山东、四川、湖南。详见附表44、45。
图 2-2 2013-2020 年医疗器械案件数及货值金额比较
从货值划分来看,货值 5 万元以下的案件占医疗器械案件总数的 97.94%。货值 50 万元以上案件共有 111 件,分布情况见下图。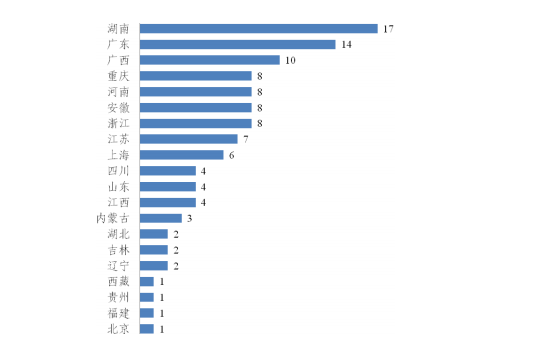
图 2-3 货值 50 万元以上医疗器械案件分布情况 单位:件
2020年医疗器械案件的主要来源是日常监管和专项检查,占案件来源总量的68.57%。从违法主体来看,违法主体为经营企业的案 件占 51.08%,违法主体为使用单位的案件占 36.94%。查处结果方面, 取缔无证经营 184 户,同比增加 38.35%;捣毁制假窝点 47 个;责令停产停业 102 户,吊销许可证 5 件,移送司法机关 330 件,刑事处罚 42 人。
图 2-4 医疗器械案件来源情况 单位:件
附表: