自新冠肺炎疫情爆发以来,疫情防控用医疗器械需求量暴涨,其中医用口罩一直站在疫情防控用品供应的最前线,出现了供应紧张的局面。浙江、广东、江苏等多省积极采取应对措施,迅速启动省级《医疗器械应急审批程序》,以助力生产企业快速合规上市,保障疫情防控物资的供应。

作为具备医用口罩生产能力,愁于如何申报的企业,面对这次应急审批,我们该如何快速的申报并通过审批?
首先,来看一下具体的流程,如图1浙江省应急审批流程,图2江苏省应急审批流程图,由于各省情况存在差异,可以通过本省药品监督管理局和医疗器械检验研究院的网站发布进行查看。例如:浙江省在药品监督管理局首页发布了《关于发布防控新型冠状病毒感染的肺炎疫情所需医疗器械应急审批程序的公告(2020)》以及在医疗器械检验研究院的网站上发布了《应急产品送检指南》。


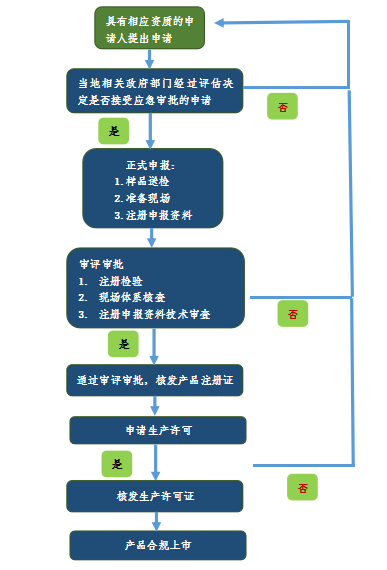
图1.浙江省应急审批流程图
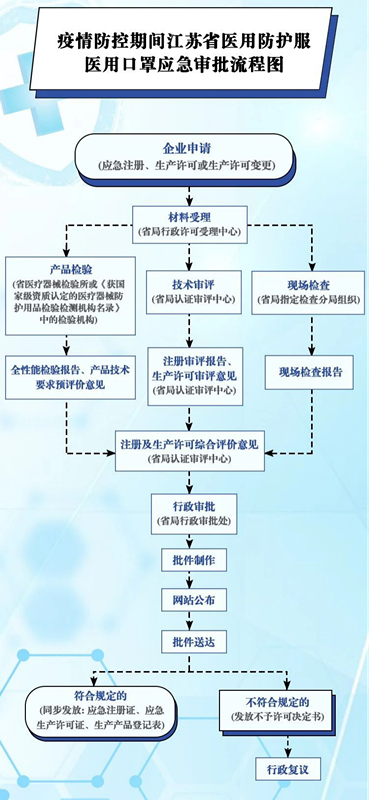
图2.江苏省应急审批流程图(来源于江苏省药监局公众号)
1. 申请应急审批的企业需要具备哪些条件?
本省内具备医用口罩生产能力的企业,例如:生产无菌医用口罩应具备不低于30万级生产环境洁净度级别,并提供相应的检测报告。
2. 正式申报和审评审批阶段
应急审批并不能豁免注册检验、体系核查和技术审评,仍需要按照流程办理,但这三项可同步进行,从而压缩整个注册周期。以最近在安徽省药监局申报的一次性使用医用口罩的应急审批为例,进度如图3所示,2月26日网上提交电子资料,2月27日通过网上预审和许可受理,在2020年02月29日接受现场体系核查。为了加快进度,先安排样品送检进行注册检测,在2月24日送检,检验周期在10-20个工作日。纵观注册检验、技术审查、体系核查的周期,正好在产品检验期间完成技术审查和体系核查。
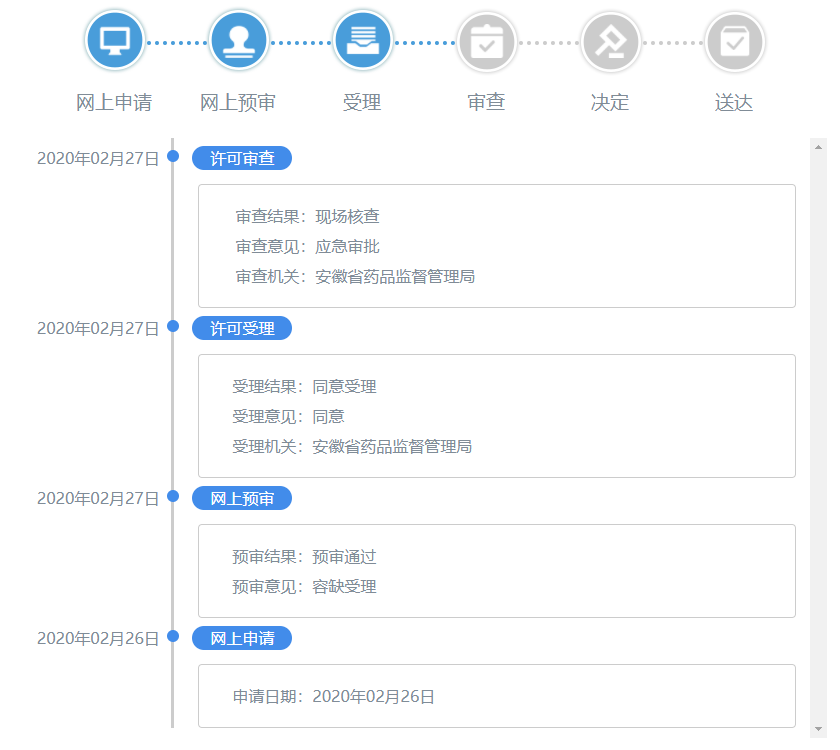
图3 产品注册进度
3. 生产许可申请
当获得产品注册证后立即提出生产许可的申请,在申报生产许可的时候需要提交产品注册证和技术要求复印件,在资料准备齐全的情况下,会快速通过审核,拿到生产许可证。
综合各地区发布的应急审批的通知,医用口罩注册的周期表1所示。
注册检验 | 体系核查 | 注册资料审查 | 行政审批 | 生产许可 | 最短周期 |
以10个工作日估算 | 以3个工作日估算 | 以5个工作日估算 | 以3个工作日估算 | 以5日估算 | 约为15个工作日 |
备注:本表仅供参考,各地区存在差异,请以当地情况为准
