一、第三类高风险医疗器械临床试验审批决定;
二、国产第三类和进口医疗器械许可事项审批决定;
三、国产第三类和进口医疗器械延续注册审批决定;
调整后审批决定由技术审评中心负责人签发,申请人对审批结果不服的,可向总局提起行政复议或依法提起行政诉讼。
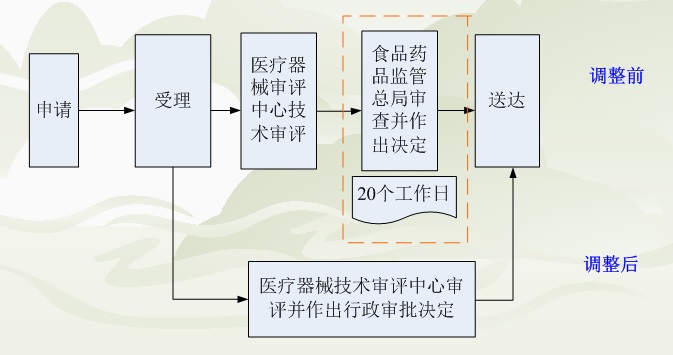
原注册审批和临床试验审批包含四个环节:受理——技术审评——行政审批——结果送达,技术审评和行政审批分别由技术审评中心和总局负责,在技术审评结束后,总局在收到技术审评意见的20个工作日内做出行政审批的决定。
调整后,技术审评和行政审批合二为一,均由技术审评中心做出决定,优化了审批流程,节省了企业审批所耗的时间。以下是调整前后审批流程图的对比图,对企业来说,调整后最大的便利就是可以节省20个工作日左右的行政审批时间。
医疗器械:
产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械生产地址发生改变的,注册人应当向原注册部门申请许可事项变更。
体外诊断试剂:
1、抗原抗体等主要材料供应商变更的;
2、检测条件、阳性判断值或参考区间变更的;
3、注册产品技术要求中所设定的项目、指标、试验方法变更的;
4、包装规格、适用机型变更的;
5、产品储存条件或产品有效期变更的;
6、增加预期用途,如增加临床适应症、增加临床测定用样本类型的;
7、进口体外诊断试剂生产地址变更的;
8、可能影响产品安全性、有效性的其他变更。
附需进行临床试验审批的第三类医疗器械目录
| 序号 | 产品 | 分类号 | 产品描述 |
| 1 | 植入式起搏/除颤器 | 6821 | 植入于体内的电子治疗仪器,由脉冲发生器和电极导线组成。起搏器产品具有起搏、感知、等功能,通过脉冲发生器发放由电池提供能量的电脉冲,通过导线电极的传导,刺激电极所接触的心肌,使心脏激动和收缩,从而达到治疗由于某些心律失常所致的心脏功能障碍的目的。除颤器可提供室性抗心动过速起搏功能和对心室除颤功能,用于对危及生命的室性心律失常的自动治疗,植入式心脏再同步复律除颤器还适用于患有充血性心力衰竭的病人,使其右心室和左心室再同步。 |
| 2 | 植入式血泵 | 6845 | 由血泵和能量转换装置组合而成,依靠微型电一机(或电一液)能量转换装置来驱动,维持正常的人体血液循环,起到部分或完全代替自然心脏的功能。 |
| 3 | 植入式药物灌注系统 | 6854 | 其药物灌注泵植入人体,与鞘内导管、导管入口组件、再灌注组件、袋囊组件、穿刺组件和程控器等配合使用,用于需长期输入药物或液体的患者。 |
| 4 | 境内市场上尚未出现的血管内支架系统 | 6846 | 与境内市场上已有的医疗器械产品相比,主要组成材料改变、重大工艺改变、主要作用机理改变或者适用范围发生重大改变的通过输送系统以经皮方式植入预期血管部位的支架 |
| 5 | 境内市场上尚未出现的植入性人工器官、接触式人工器官、骨科内固定产品及骨科填充材料 | 6846 | 与境内市场上已有的医疗器械产品相比,主要组成材料改变、重大工艺改变、主要作用机理改变或者适用范围发生重大改变的植入性人工器官、接触式人工器官、骨科内固定产品及骨科填充材料。 |
| 6 | 可吸收四肢长骨内固定产品 | 6846 | 由可吸收高分子材料或可吸收金属材料制成的四肢长骨内固定产品,通过对骨折断端的连接、固定,实现骨折部位的复位及早期负重,适用于四肢长骨骨折内固定。 |
| 7 | 纳米骨科植入物 | 6846 | 含有纳米级材料或由纳米技术制成的骨科植入物,通过纳米级材料及纳米工艺的特性和效应,实现骨科植入物的临床要求,适用于骨及附属组织的支持、固定、替代。 |
| 8 | 定制增材制造(3D打印)骨科植入物 | 6846 | 利用增材制造(3D打印)工艺生产的骨科植入物,根据产品的三维数字模型,主要通过连续的物理叠加,逐层增加材料生成三维实体,可实现骨科植入物的个性化生产及精细加工,适用于骨及附属组织的支持、固定、替代。 |
