2015年6月8日,国家食品药品监督管理总局发布“境内第三类医疗器械注册质量管理体系核查工作程序(暂行)”(食药监械管【2015】63号),该通知明确了境内第三类医疗器械注册过程中的体系核查要求,规范了核查程序,并为境内第二类医疗器械注册体系核查提供了法规依据。
依据该通知要求,企业应在提交注册之前建立医疗器械生产质量管理体系并在该体系下生产注册样品及完成生产工艺验证工作。- 注册质量管理体系核查范围
- 国产第三类医疗器械注册
- 国产第二类医疗器械注册
- 进口第二类、第三类医疗器械(注册体系核查办法另行制定)
- 核查机构
- 国家食品药品监督管理总局技术审评机构
- 企业所在地省、自治区或直辖市食品药品监督管理部门
- 核查依据
- 核查内容
- 核查程序
| 核查程序 | 工作内容 | 周期 (工作日) |
 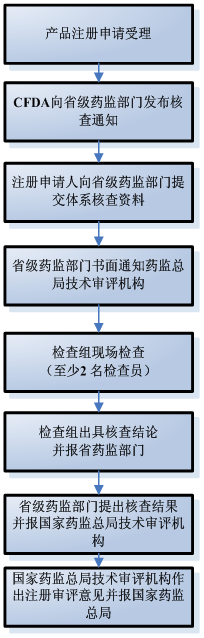 | 国家食品药品监督管理总局行政服务中心受理医疗器械产品注册申请 | 5 |
| 药监总局技术审评机构自收到医疗器械注册申请资料起30个工作日内,通知相应省、自治区、直辖市食品药品监督管理部门开展注册质量管理体系核查。 | 30 | |
| 注册申请人应当在注册申请受理后10个工作日内向省、自治区、直辖市食品药品监督管理部门提交体系核查资料 | 10 | |
| 省、自治区、直辖市食品药品监督管理部门在开展现场检查5个工作日前书面通知总局技术审评机构 | 提前5日 | |
| 检查制定现场检查方案,组织召开现场检查并提出检查结论。 | 1-3 | |
| 检查组将建议核查结果报省药监部门,建议结论分为“通过检查”、“整改后复查”、“未通过检查”三种情况 | 30 | |
| 省药监部门对检查组提交的现场检查资料进行审核,提出核查结论,核查结论为“通过核查”、“整改后复查”、“未通过核查”三种情况,10日并报总局技术审评机构。 | ||
| 总技术审评中心依据体系核查结果,作为医疗器械注册技术审评结果的判断依据,未通过核查的,技术审评中心提出不予注册的审评意见,食品药品监督管理部门作出不予注册的决定。 |
- 核查资料要求
- 注册申请人基本情况表
- 注册申请人组织机构图
- 企业总平面布置图、生产区域分布图
- 如生产过程有净化要求的应提供有资质的检测机构出具的环境检测报告(附平面布局图)复印件
- 产品生产工艺流程图,应标明主要控制点与项目及主要原材料、采购件的来源及质量控制方法
- 主要生产设备和检验设备(包括进货检验、过程检验、出厂的最终检验相关设备;如需净化生产的,还应提供环境监测设备)目录
- 企业质量管理体系自查报告
- 拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的对比说明(如适用)
- 注册申报资料复印件:
- 医疗器械(不包括体外诊断试剂):研究资料、产品技术要求、注册检验报告、临床试验报告(如有)、医疗器械安全有效基本要求清单
- 体外诊断试剂:主要生产工艺及反应体系的研究资料(第三类体外诊断试剂)、产品技术要求、注册检验报告、临床试验报告(如有)
