临床评价等于临床试验吗?
答案当然是否定的。
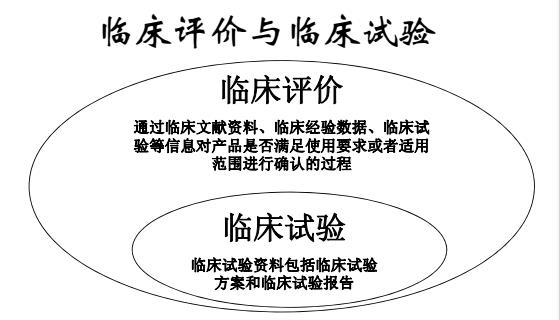
医疗器械临床评价是指注册申请人通过临床文献资料、临床经验数据、临床试验等信息对产品是否满足使用要求或者适用范围进行确认的过程。
而完成临床评价的路径各异,临床试验只是其中的一种,也是周期长投入最大的一条路径。
据相关法规规定:“临床评价资料应当包括临床试验报告,但依照本条例第十七条的规定免于进行临床试验的医疗器械除外。第二十二条 办理第一类医疗器械备案,不需进行临床试验。申请第二类、第三类医疗器械注册,应当进行临床试验。
所以说,临床试验与临床评价是从属关系。
什么时候需要进行临床评价?
根据《医疗器械监督管理条例》(国务院令第650号):医疗器械产品注册,应当提交临床评价资料;临床评价资料不限于临床试验报告,也可以是通过文献、同类产品临床使用获得的数据证明该医疗器械安全、有效的资料。
对于需要在中国境内开展临床试验的项目,临床试验的安排在注册检验报告获得之后,部分产品需要生物学评价报告甚至是动物试验报告,才可进行临床试验伦理立项。
关于临床评价工作的时间安排,我们建议在注册检测完成后,临床评价工作即可和注册卷宗的编写以及生产体系的建设同期开展,以求最大程度缩短注册申报的周期。产品决策临床评价路径的一般流程:
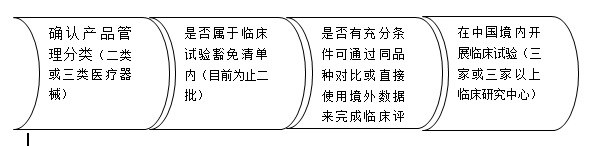
| 医疗器械临床试验范围 | |||||
| 免于进行临床实验 | 免于进行临床实验,申报注册时予以说明,并提交相关证明资料 | 相关证明资料+临床试验 | 进行临床试验 | 经审批方可进行临床试验 | |
| 第一类 | 全部产品 | ||||
| 第二类 | 免于进行临床实验的医疗器械目录 | 通过同品种医疗器械临床试验或者临床使用数据进行分析评价,能够证明该医疗器械安全、有效的 |
| 不符合免于临床试验情形的 | |
| 第三类 | 需进行临床试验审批的第三类医疗器械目录 | ||||
