01
贝克曼库尔特实验系统(苏州)有限公司对肌酸激酶同工酶检测试剂盒(免疫抑制法)主动召回
贝克曼库尔特实验系统(苏州)有限公司报告,该企业在内部干扰测试期间,发现CK-MB(货号OSR61155)未能符合使用说明(IFU)中所述的脂血干扰声明,现主动召回,召回级别为三级。涉及产品的具体信息见《医疗器械召回事件报告表》

02
生物梅里埃法国股份有限公司bioMerieux, SA对巨细胞病毒IgM抗体检测试剂盒(酶联免疫荧光法)VIDAS® CMV IgM (CMVM)主动召回
梅里埃诊断产品(上海)有限公司报告,由于涉及特定型号、特定批次产品存在校准品RFV值高出可接受范围的问题,生产商生物梅里埃法国股份有限公司bioMerieux, SA对巨细胞病毒IgM抗体检测试剂盒(酶联免疫荧光法)VIDAS CMV IgM (CMVM)(注册证号:国械注进20153400764)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
CMV IgM (CMVM)(注册证号:国械注进20153400764)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。

03
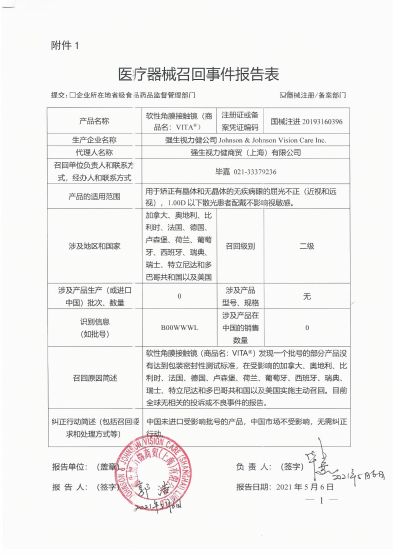
强生视力健公司Johnson & Johnson Vision Care Inc.对软性角膜接触镜ACUVUE® VITA™ Brand Contact Lenses主动召回
强生视力健商贸(上海)有限公司报告,由于涉及特定型号、特定批次部分产品存在没有达到包装密封性测试标准的问题,生产商强生视力健公司Johnson & Johnson Vision Care Inc.对软性角膜接触镜ACUVUE VITATM Brand Contact Lenses(注册证号:国械注进20193160396)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
VITATM Brand Contact Lenses(注册证号:国械注进20193160396)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
04
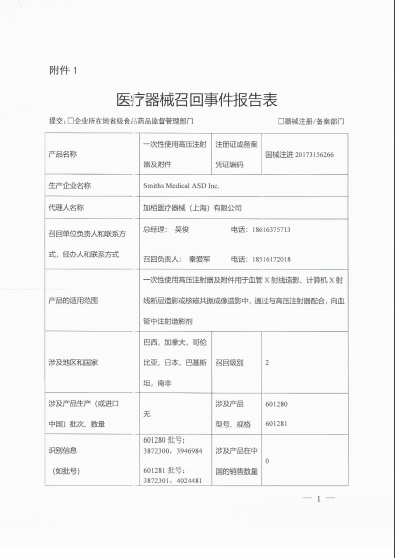
理博有限公司/ Liebel-Flarsheim Company LLC对一次性使用高压注射器及附件Disposables Associated with Power Injectors主动召回
加栢医疗器械(上海)有限公司报告,由于涉及特定型号、特定批次产品可能存在连接器焊接不充分或不完整,在高压情况下可能失效,导致严重损害的问题,生产商理博有限公司/ Liebel-Flarsheim Company LLC对一次性使用高压注射器及附件Disposables Associated with Power Injectors(注册证号:国械注进20173156266)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。

05
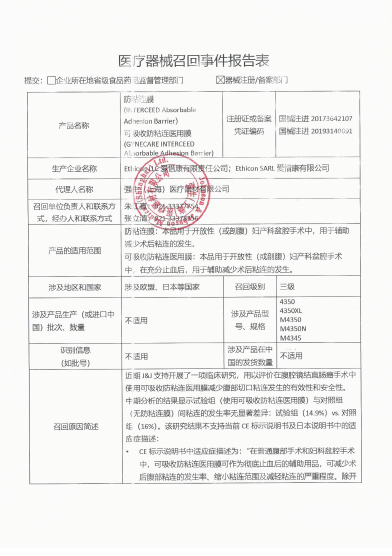
Ethicon LLC对防粘连膜主动召回和Ethicon SARL对可吸收防粘连医用膜主动召回
强生(上海)医疗器材有限公司报告,由于涉及特定型号、特定批次产品在一项临床研究中,中期分析结果显示试验组与对照组间粘连的发生率无显著差异的问题,生产商Ethicon LLC对防粘连膜INTERCEED Absorbable Adhesion Barrier(注册证号:国械注进20173642107)主动召回和生产商Ethicon SARL对可吸收防粘连医用膜GYNECARE INTERCEED Absorbable Adhesion Barrier(注册证号:国械注进20193140091)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。


06
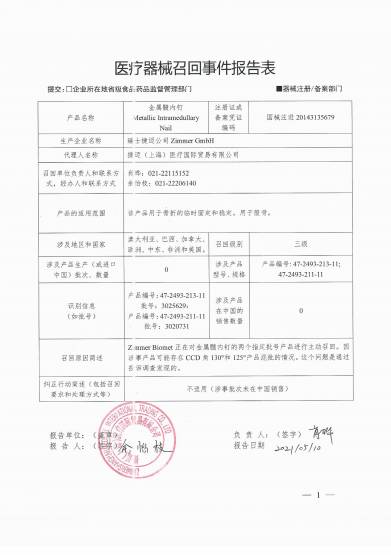
瑞士捷迈公司Zimmer GmbH对金属髓内钉Metallic Intramedullary Nail主动召回
07
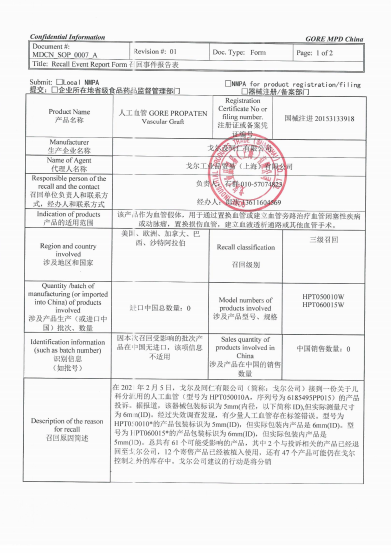
戈尔及同仁有限公司W.L. Gore & Associates, Inc.
对人工血管GORE PROPATEN Vascular Graft主动召回
戈尔工业品贸易(上海)有限公司报告,由于涉及特定型号、特定批次产品存在标签错误的问题,生产商戈尔及同仁有限公司W.L. Gore & Associates, Inc.对人工血管GORE PROPATEN Vascular Graft(注册证号:国械注进20153133918)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。