手术衣作为疫情防控的重要医用防护产品,依据中国医疗器械法规,手术衣按照第二类医疗器械管理,产品在中国上市销售必须先获得中国药监部门批准的医疗器械注册证才能进行销售和使用,国产的手术衣产品除了获得医疗器械注册证还应申办医疗器械生产许可证方可进行生产销售。瑞旭集团结合医用防护产品注册申报经验,针对手术衣注册申报细节进行汇总分享。
1. 手术衣产品概述
- 产品名称举例:手术服、手术衣、一次性使用无菌手术衣
- 分类编码及分类:14-13-05,二类器械
- 结构组成:通常为基材和阻水层组成的手术室服装。基材一般由非织造布或纺织布制造,阻水层为阻水性的材料。手术衣分为无菌提供一次性使用和非无菌提供可重复使用两种供应形式。手术衣按关键区域的屏障能力分为标准型和高性能型两种。
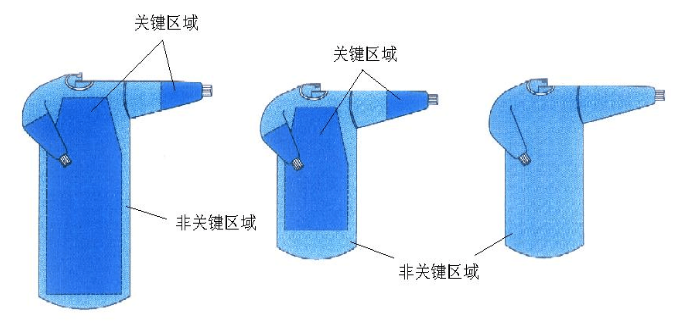
- 适用范围:用于穿在手术医生和擦拭护士身上,起到防止医生身体上的皮屑弥散到开放的手术创面和手术病人的体液向医务人员传播,起到双向生物防护的作用。
- 预期用途:一次性使用手术衣用于防止手术过程和其他有创检查中病人和医护人员之间感染原的传播。其中高性能手术衣适用于病人血液中已知有传染性病毒或紧急抢救时未知血液中是否有传染性病毒的手术;标准性能手术衣适用于已知病人血液中无传染性病毒的手术。
2. 手术衣注册单元划分
一次性使用无菌手术衣和可重复使用的非无菌手术衣不属于同一个注册单元,应单独进行注册申报。
3. 手术注册申报临床试验要求
手术衣产品列入免于进行临床试验的医疗器械产品目录,可免于进行临床试验,只需要提交临床评价资料,其免临床产品应符合免临床目录的规定:
分类编码 名称 产品描述 类别 14-13-05 可重复使用手术衣 通常为基材和阻水层组成的手术室服装。基材一般由非织造布或纺织布制造,阻水层为阻水性的材料。非无菌提供可重复使用。手术衣按关键区域的屏障能力分为标准型和高性能型两种。 Ⅱ 14-13-05 一次性使用手术衣帽 一次性使用手术衣帽一般由具有一定防护特性的无纺布或覆膜无纺布复合材料制成;其中手术衣可由衣领、衣身、衣袖组成,也可由上衣、裤子组成,袖口、脚踝口为弹性收口,腰部收口可采用弹性收口、拉绳收口或搭扣;前襟、肘部等可设计成加强防护,以无菌形式提供,供手术人员穿着,降低感染源向病人手术创面传播以防止术后创面感染;具有阻止液体透过的手术衣,也可减小血液或体液中携带的感染源向手术人员传播的风险。产品性能指标采用下列参考标准中的适用部分,如: YY/T 0506 病人、医护人员和器械用手术单、手术衣和洁净服。 Ⅱ
4. 技术要求
4.1规格尺寸
企业应明确指出申报产品所包含的规格尺寸和允差要求。YY/T0506-2009《病人、医护人员和器械用手术单、手术衣和洁净服》中性能要求见下表:
性能名称 | 单位 | 要求 | ||||
标准性能 | 高性能 | |||||
产品关键区域 | 产品非关键区域 | 产品关键区域 | 产品非关键区域 | |||
阻微生物穿透-干态 | CFU | 不要求 | ≤300a | 不要求 | ≤300a | |
阻微生物穿透-湿态 | IB | ≥2.8b | 不要求 | 6.0b,c | 不要求 | |
洁净度-微生物 | (cfu/dm2) | ≤300 | ≤300 | ≤300 | ≤300 | |
洁净度-微粒物质 | IPM | ≤3.5 | ≤3.5 | ≤3.5 | ≤3.5 | |
落絮 | Log10(落絮计数) | ≤4.0 | ≤4.0 | ≤4.0 | ≤4.0 | |
抗渗水性 | cmH2O | ≥20 | ≥10 | ≥100 | ≥10 | |
胀破强度-干态 | kPa | ≥40 | ≥40 | ≥40 | ≥40 | |
胀破强度-湿态 | kPa | ≥40 | 不要求 | ≥40 | 不要求 | |
拉伸强度-干态 | N | ≥20 | ≥20 | ≥20 | ≥20 | |
拉伸强度-湿态 | N | ≥20 | 不要求 | ≥20 | 不要求 | |
注:a试验条件:挑战菌浓度为108CFU/g滑石粉,振动时间为30min。
b用YY/T0506.6试验时,在95%的置信水平处的IB的最小显著性差异为0.98。这是区分两个材料之间有所不同的最小差异。小于等于0.98IB的材料变动可能无差异;而大于0.98IB则可能有差异(95%的置信水平意味着进行20次试验,至少有19次是正确的)。
c本部分中IB=6.0时,意味着无穿透。IB=6.0是最大可接受值。
4.2透气性
制造商应结合临床具体应用对产品的透气性进行评价,并对各区域标示透气性指标。YY0506.8-2019规定,若声称产品具有最高透气性,按照YY0506.2中规定的方法试验,其非关键区域的透气性应不低于150mm/s。
4.3无菌要求
一次性使用手术衣应无菌。
4.4化学性能要求
若采用环氧乙烷灭菌,环氧乙烷残留量应不大于10 mg/kg。
4.5结构要求
如有系带应规定系带长度、系带固定的牢固度等。YY0506.8-2019规定,颈部和腰部系带应能承受10N的轴向静拉力,持续1min无断裂火脱落
4.6重复次数
可重复使用的手术衣应明确灭菌方式和使用次数。
4. 主要参考技术标准或规范
一次性使用手术衣产品注册技术审查指导原则 | |
GB/T 16886.1-2011 | 医疗器械生物学评价 第1部分:评价与试验 |
GB/T 16886.7-2015 | 医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量 |
GB/T 16886.10-2017 | 医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验 |
YY/T 0316-2016 | 医疗器械风险管理对医疗器械的应用 |
YY/T 0506.1-2005 | 病人、医护人员和器械用手术单、手术衣和洁净服 第1部分制衣厂、处理厂和产品的通用要求 |
YY/T 0506.2-2016 | 病人、医护人员和器械用手术单、手术衣和洁净服 第2部分:性能要求和试验方法 |
YY∕T 0506.4-2016 | 病人、医护人员和器械用手术单、手术衣和洁净服 第4部分干态落絮试验方法 |
YY/T 0506.5-2009 | 病人、医护人员和器械用手术单、手术衣和洁净服 第5部分:阻干态微生物穿透试验方法 |
YY/T 0506.6-2009 | 病人、医护人员和器械用手术单、手术衣和洁净服 第6部分:阻湿态微生物穿透试验方法 |
YY∕T 0506.7-2014 | 病人、医护人员和器械用手术单、手术衣和洁净服 第7部分洁净度-微生物试验方法 |
YY/T 0506.8-2019 (2020年8月1日实施) | 病人、医护人员和器械用手术单、手术衣和洁净服 第8部分:产品专用要求 |
5. 手术检测要求
手术衣检测项目主要包括技术要求中性能指标及生物学:刺激与迟发型超敏反应试验。
6. 手术衣注册审批周期
手术衣在一般审批情况下,其注册审批周期为80工作日(不含补正过程):
- 技术审评:60个工作日,发补后再60个工作日;
- 行政审批:20个工作日。
瑞旭集团提醒各企业,若通过应急审批进行的注册申报,则技术审评和行政审批时间根据各省规定加快审批,最快审批周期可能加快至几个工作日完成审批,但是应急审批的批件有效期也是有规定,一般期限不会超过1年。
