新《医疗器械监督管理条例》(国务院650号令)已于2014年6月1日正式实施,其配套的《医疗器械注册管理办法》(4号令),也已于2014年10月1日正式实施,新实施的法规明确了企业在注册前需要按照质量体系的要求研制样品,进行必要的基础研究,并在注册时向主管药监局提交相应的研究资料。CFDA在2015年5月27日发布了 《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告(2015年第53号)》,该通告明确了产品注册不被许可的情况,注册费用将不予退回。而目前不被许可的大部分企业产品在研发阶段基础研究不够充分,不能充分证明产品的安全有效性。
因此,在研发阶段注册资料准备的是否充分将直接决定企业的注册成本、产品能否上市或注册的周期。
瑞旭技术建议企业在研发阶段应由相关技术人员介入,避免企业在产品设计开发阶段由于某方面的缺失导致基础研究不充分。
以下是企业在研发阶段建议参与的人员及相关职责| 设计开发阶段需要介入的人员 | 职责 |
| 医疗器械法规专员 | 收集法规,标准,质量体系的培训及宣贯 |
| 医疗器械开发技术人员 | 产品设计,试产,验证,检测,技术及工艺输出 |
| 医疗器械临床人员 | 临床使用要求,风险点,临床试验指导 |
| 医疗器械市场专员 | 市场调研,临床需要 |
| 设计专员 | 协助开发技术人员外形设计及包装标签设计 |
瑞旭技术根据产品研制及申报过程,建议企业可以参照下图进行研制时注册资料准备。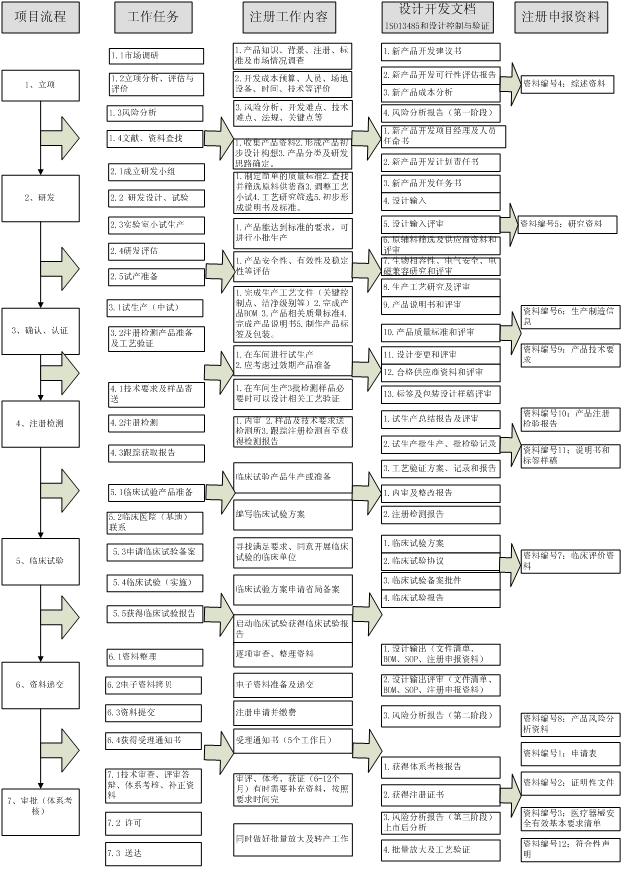
根据以上产品的研发及申报流程,瑞旭技术建议企业在整个研发过程均应由注册人员参与,避免产品在已经定型后,不符合相关法规的要求而导致时间,财力及人力的浪费。
