对于未列入《免于进行临床试验的医疗器械目录》的医疗器械产品,也可以与同类已上市产品进行比对,通过临床数据收集及分析评价等资料证明两者基本等同,从而完成临评价过程。本文介绍了同品种医疗器械临床评价的具体要求及评价流程。
1.什么是同品种医疗器械?
同品种医疗器械是指与申报产品在基本原理、结构组成、制造材料(有源类产品为与人体接触部分的制造材料)、生产工艺、性能要求、安全性评价、符合的国家/行业标准、预期用途等方面基本等同的已获准境内注册的产品。其中申报产品与同品种医疗器械的差异不对产品的安全有效性产生不利影响,可视为基本等同。
2.同品种医疗器械的判定
通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价,证明医疗器械安全、有效。申报产品与同品种医疗器械对比项目如下表:
无 源 医 疗 器 械 | 对比项目 | 有源医疗器械 | 对比项目 |
1.基本原理 | 1.基本原理 (1)工作原理 (2)作用机理 | ||
2.结构组成 | 2.结构组成 (1)产品组成 (2)核心部件 | ||
3.生产工艺 | 3.生产工艺 | ||
4.制造材料(如材料牌号、动物源性材料、同种异体材料、成分、药物成分、生物活性物质、符合的标准等信息) | 4.与人体接触部分的制造材料(如材料牌号、动物源性材料、同种异体材料、成分、药物成分、生物活性物质、符合的标准等信息) | ||
5.性能要求 | 5.性能要求 (1)性能参数 (2)功能参数 | ||
6.安全性评价(如生物相容性、生物安全性等) | 6.安全性评价(如生物相容性、生物安全性、电气安全性、辐射安全性等) | ||
7.产品符合的国家/行业标准 | 7.软件核心功能 | ||
8.适用范围: (1)适用人群 (2)适用部位 (3)与人体接触方式 (4)适应症 (5)适用的疾病阶段和程度 (6)使用环境 | 8.产品符合的国家/行业标准 | ||
9.使用方法 | 9.适用范围: (1)适用人群 (2)适用部位 (3)与人体接触方式 (4)适应症 (5)适用的疾病阶段和程度 (6)使用环境 | ||
10.禁忌症 | 10.使用方法 | ||
11.防范措施和警告 | 11.禁忌症 | ||
12.交付状态 | 12.防范措施和警告 | ||
13.灭菌/消毒方式 | 13.灭菌/消毒方式 | ||
14.包装 | 14.包装 | ||
15.标签 | 15.标签 | ||
16.产品说明书 | 16.产品说明书 |
通过上表项目的对比,证明申报产品与同品种医疗器械基本等同,对差异性部分应说明是否对产品的安全有效性产生不利影响,并通过申报产品自身的数据进行验证或确认,如申报产品的非临床研究数据、临床文献数据、临床经验数据或针对差异性开展的临床试验数据。
3.同品种医疗器械临床评价路径
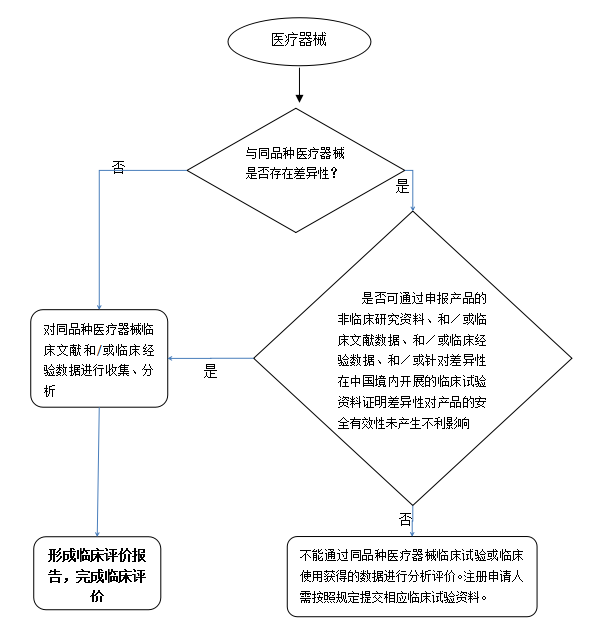
4.同品种医疗器临床评价主要收集资料
申报产品 | 同品种已上市医疗器械 |
1. 非临床研究资料 2. 临床文献和未发表的临床研究资料 3. 投诉和不良事件 4. 与临床风险相关的纠正措施 5. 中国人群临床研究数据 | 1. 临床文献和已经完成但未发表的临床研究资料 2. 投诉和不良事件 3. 与临床风险相关的纠正措施 4. 中国人群临床临床研究数据 |
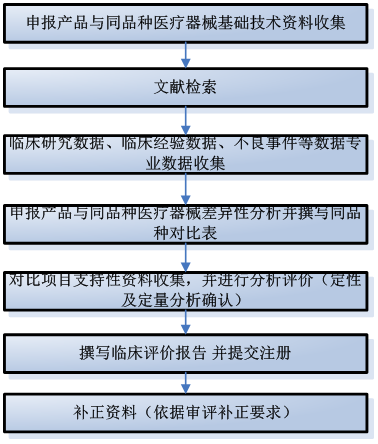
5.同品种医疗器械对比临床评价流程