疫情期间为保障应急医疗物质供应,国家及省级药监局于2020年1月底先后启动医疗器械应急审批程序,应急审批医疗器械包括口罩、隔离衣、医用手套、红外体温计、医用防护服等医用防护类医疗器械。那么应急审批流程是否会比常规审批简化一些呢?到底需要提交哪些资料呢?本文整理了应急审批申报与常规注册申报在流程和资料要求两个方面的区别,希望能给企业提供一些帮助。
1.申报审批流程的区别
各省份针对符合疫情防控所需的第二类医疗器械的应急审批申请,均相应的开通了绿色通道,提前介入指导,加快审评审批。与常规注册流程相比,应急审批的注册流程并没有减少,而是采取了一系列措施有效压缩了注册时长。如将审评审批各环节由“串联”改为“并联”,将注册检验、注册核查、审评、审批等环节平行进行,产品注册核查和生产许可现场检查合并开展,从而确保企业尽快取得注册证及生产许可证。
以浙江省为例,应急审批流程图如下。
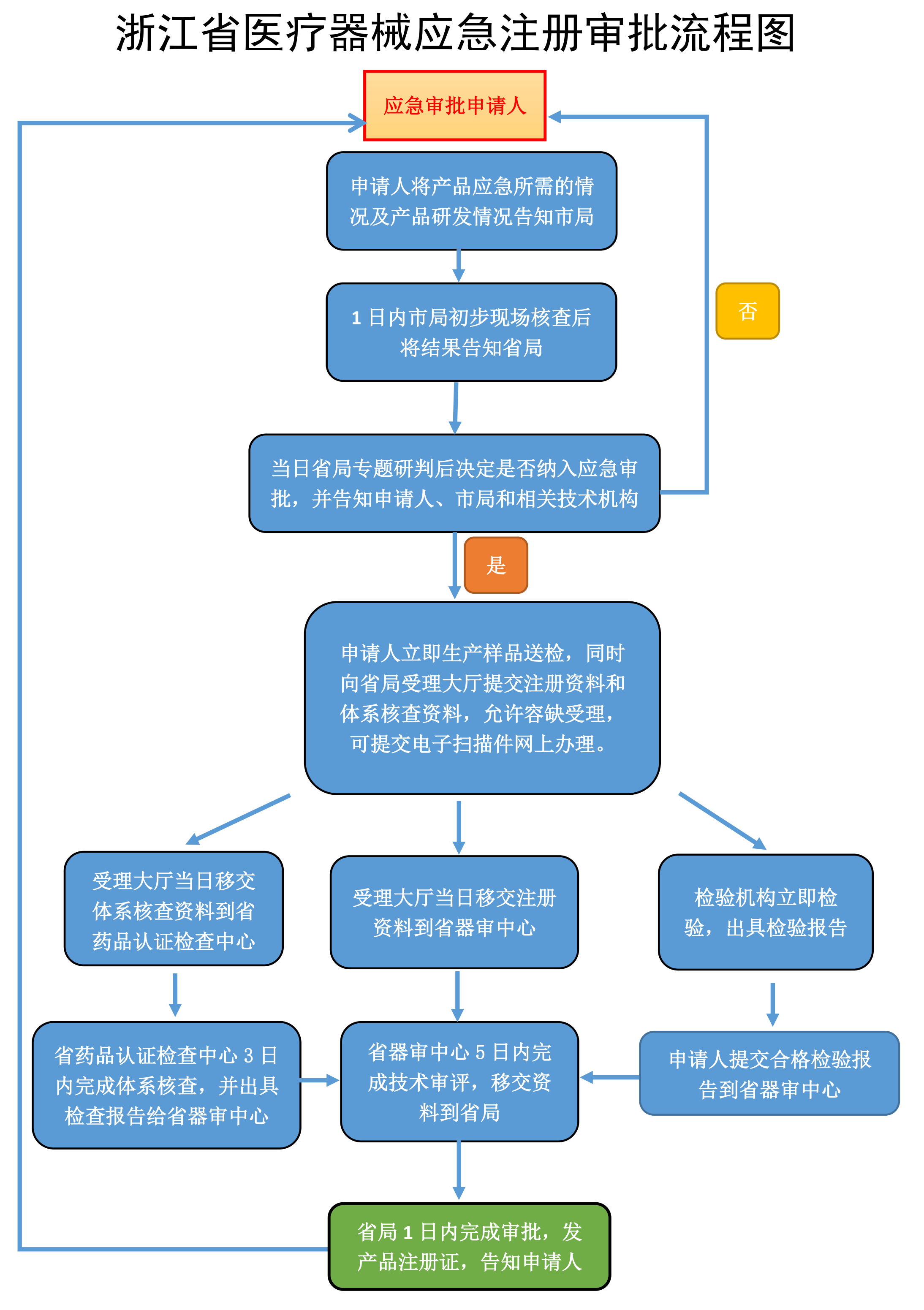
2.申报资料的区别
在应急审批注册申报资料方面,各省份均采取了容缺受理,一般情况下“医疗器械安全有效基本要求清单”“临床评价资料”“产品风险分析资料”这三份资料可以不用提交,其余资料因省份不同而有所差异。下面列举了常规申报资料及部分省份的应急审批资料。
常规注册申报资料 | 应急申报资料 | |||
一级标题 | 申报资料二级标题 | 一级标题 | 申报资料二级标题 | |
1.申请表 |
| 1.申请表 |
| |
2.证明性文件 |
| 2.证明性文件 |
| |
3.医疗器械安全有效基本要求清单 |
| 医疗器械安全有效基本要求清单 | 选报 | |
4.综述资料 | 4.1概述 | 3.综述资料 | 3.1概述 | |
5.研究资料 | 5.1产品性能研究 | 4.研究资料 | 4.1产品性能研究 | |
6.生产制造信息 | 6.1 无源产品/有源产品生产过程信息描述 | 5.生产制造信息 | 5.1生产过程信息描述 | |
7.临床评价资料 |
| 临床评价资料 | 选报 | |
8.产品风险分析资料 |
| 产品风险分析资料 | 选报 | |
9.产品技术要求 |
| 6.产品技术要求 |
| |
10.产品注册检验报告 | 10.1注册检验报告 | 7.产品注册检验报告 | 7.1注册检验报告 | |
11.说明书和标签样稿 | 11.1说明书 | 8.说明书和标签样稿 | 8.1说明书 | |
|
| 9.注册质量管理体系核查申请表 | 江苏省要求 | |
12.符合性声明 |
| 10.符合性声明 |
| |
以上申报资料是参考部分省份申报资料要求及瑞旭集团注册申报经验整理,具体各省医疗器械注册申报过程资料要求会有些差异,请企业在申报过程中结合当地申报要求准备注册申报资料。
