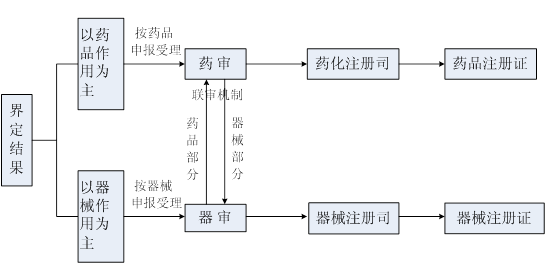
2009年11月,总局发布了《药械组合产品注册有关事宜的通告》,对药械组合产品的定义、属性界定、注册要求等作出解释。文件指出以药品作用为主的组合产品,需要申报药品注册;以器械作用为主的组合产品,需要申报医疗器械注册。文件进一步明确了组合产品的管理类别,带药物涂层的支架、带抗菌涂层的导管、含药避孕套、含药节育环等产品,按医疗器械进行注册管理,含抗菌、消炎药品的创口贴、中药外用贴敷类产品等按药品进行注册管理。
药械组合产品联合审评审批流程:
注册申报时需要提交的文件
| 申请表 | 注明药械组合产品 | |
产品技术报告(11项) | 1.含药器械描述 | 产品结构组成、制造材料、预期用途、空间结构;所含药物的名称(通用名及英文名)、化学结构式、分子量、分子式、商品名称、组成成份、含量、作用、在药械中的预期功能及与器械的组合方式 |
2.药物的来源质量要求等信息 | 国内上市药品(含原料药)提供《医药产品注册证》或《进口药品注册证》复印件,未上市的按相关规定办理; 若药物外购则需提供双方供货协议或同类证明性文件,并明确生产者对药物质量的要求; 对所含药物与在国内已经上市的药物在给药途径、作用方式、给药剂量等方面进行比较,证明已上市药品的安全性、稳定性在器械中的适用性; 牛源性药物、麻醉药物、精神药物、属于新药的放射性药物应符合我国相关规定 | |
| 3.质量稳定性材料 | 明确药械中药物载体材料来源及质量要求 | |
| 4.药物研究资料综述 | 包括药学、药理毒理、药代动力学等研究资料综述及已上市的药物临床不良反应综述 | |
5.生产工艺 | 生产工艺流程及关键点控制研究资料,特别是药物与器械结合工艺的研究资料和药物与器械结合后的产品加工工艺(如灭菌)对药物性能影响的研究资料,药物与器械相互作用的研究资料,含多种药物的还需提供药物相互作用研究资料 | |
| 6.药物含量选择依据研究资料或文献资料 | ||
| 7.药物释放速率研究资料或文献资料 | 释放形式为缓释或控释的药物 | |
| 8.稳定性研究资料 | 考查产品在温度湿度等环境因素下保持原有特性的能力确定产品的贮存条件及有效期 | |
| 9.生物安全性评价资料 | 含药物作用于局部的耐受性研究资料,若选用药物在生殖毒性、长期毒性、致癌性、依赖性等方面存在风险,应提供相关试验资料或文献资料 | |
| 10.药械的药效学评价资料 | ||
| 11.药械的药代动力学研究资料或文献资料 | ||
| 产品标准 | 药物名称、含量 | |
| 药物定性、定量的技术要求及检测方法 | ||
| 药物在器械中的控制释放量的指标及检测方法,标准编制说明中明确其确定依据 | ||
| 在运输、贮藏方面是否有特殊要求 | ||
| 其他 | ||
| 产品说明书 | 药物名称(通用名)、成份、含量、预期功能 | |
| 在药械中的特殊剂量及给药途径在可能出现的不良反应 | ||
| 在运输、贮藏方面是否有特殊要求 | ||
| 其他 | ||
| 其他 | ||
如果大家对具体注册步骤和相关注意事项感兴趣,可以阅读我们之前的文章《药械组合医疗器械如何申报注册》。
