近日,在中国医疗器械行业协会2016年政策年会上,总局医疗器械评审中心(CMDE)孔主任介绍了2016年医疗器械评审工作进展及2017年工作部署:
- 2016年审评工作完成情况;
- 医疗器械评审制度改革情况;
- 2017年工作重点。
一 2016年审评任务完成情况
1.评审项目任务完成情况
2016年项目审评接收和完成情况如图所示。16年共展开专家评审咨询会187项,同比下降29%;发出补充资料通知单5290份,同比下降7%。在推进医疗器械评审制度改革的同时,基本保障了产品评审项目的进出平衡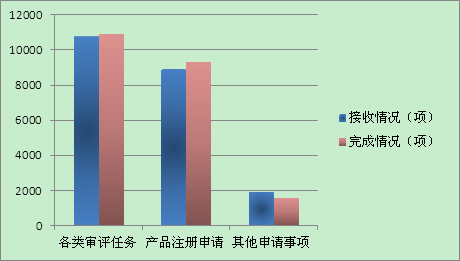
2.创新医疗器械审查评审完成情况
2016年共接收创新医疗器械审评项目197项,完成审查144项,通过45项,通过率31%。其中体外诊断试剂占22%,有源产品占33%,无源产品占45%。(我不清楚是通过项目的比例还是申报占的比例)
对已经进入审评程序的15项创新医疗器械项目进行小组审评,完成了人工晶状体、三维心脏电生理标测系统、药物洗脱球囊扩张导管等10余项创新产品审评,缩短创新产品首次审评近60%的审评时间,有效推动了创新产品的注册过程。
二 医疗器械评审制度改革情况
1. 相关法规
- 2015年8月 《关于改革药品医疗器械审评审批制度的意见》(国发[2015]44号)
- 2015年10月 《国家食品药品监督管理总局医疗器械技术审评中心综合改革方案》(食药监协管[2015]231号)
2. 优化再造审评流程
原有流程:主审评审 技术复审 主任签发
重点引入:
项目小组评审机制
注册前体系核查机制
技术委员会集体决策机制
审评质量监督评查机制
3. 建立“三分法”评审机制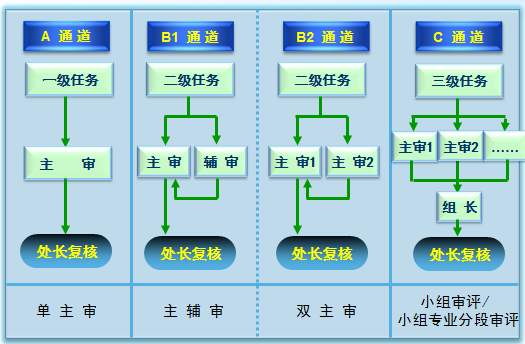
4. 建立中心技术委员会集体决策制度
实行重大事项共同商议、集体决策、统一评审尺度
5. 建立评审质量管理制度
《医疗器械技术评审质量管理规范(试行)》
《医疗器械注册技术审评报告质量管理规定(试行)》
6. 建立岗前培训和继续教育培训制度
7. 建立评审员资格考试管理制度
- 制定《医疗器械技术审评中心审评资格评定办法(试行)》
- 对各类产品注册申请按不同注册形式、产品代码和模块代码进行评审资格分类
- 要求评审员加收培训、考核合格后持证上岗
8. 积极推进优先审评制度
- 《创新医疗器械特别审批申请审查操作规范》
- 《医疗器械优先审批申请审核操作规范》
- 设立特别通道,对创新医疗器械和临床急需、国家重点支持项目产品予以优先审评
9. 建立专家咨询委员会制度
10. 建立交流沟通制度
- 《医疗器械技术审评咨询管理规范》
- 《医疗器械审评沟通交流管理办法》
- 引入信息化预约机制
- 为创新审批和优先审批设立特殊交流渠道
11. 强化信息公开制度
- 在中心门户网站公开指导原则、技术规章、审评人员信息、产品审评范围、进度查询、创新产品特别审批等情况
- 进一步扩大医疗器械审评信息公示内容
三 2017年工作重点
1. 稳步推进审评制度改革
- 继续完善项目小组审评制度
- 实施专家咨询委员会与技术争议解决制度
- 继续完善交流沟通制度
- 积极推进优先审评制度
- 做好相关医疗器械行政审批承接工作
2. 持续推动审评科学建设
- 加强审评质量管理体系建设
- 加强审评指导原则制修订工作
- 推进审评信息化建设
3. 着力强化人才队伍建设
- 积极推进人才招聘工作
- 开展全员岗位招聘管理
- 继续强化人才培训
- 继续优化中心内部职能分工
医疗器械审评程序改革将使得审评程序更加合理化、规范化,审评人员更加专业化,审评信息更信息化。从中我们也可看到国家对创新医疗器械项目的重视,企业应紧跟政治导向,加强自主创新能力建设,提高综合竞争能力。
