注册人制度下产品注册申报
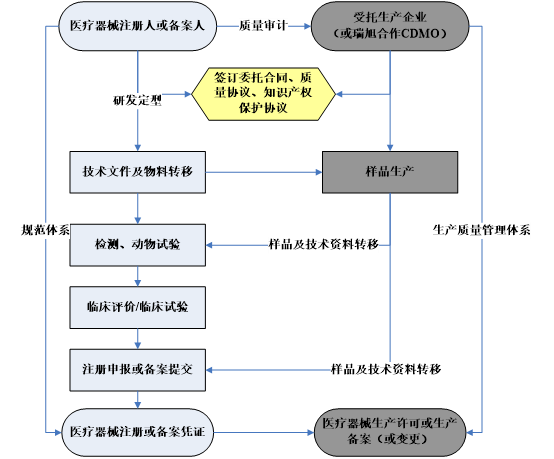
依据《医疗器械监督管理条例》及《医疗器械生产监督管理办法》规定,医疗器械注册人、备案人可以自行生产医疗器械,也可以委托具备相应生产能力的企业生产医疗器械,医疗器械注册人、备案人承担医疗器械质量主体责任并按要求申办医疗器械注册证或备案凭证,受托生产企业提交注册人或备案人的医疗器械注册证或备案凭证申办医疗器械生产许可证或生产备案凭证。其中具有高风险的植入性医疗器械不得委托生产。
注册人制度下医疗器械注册或备案流程
我们的服务
受托生产企业筛选及质量审计
受托生产及研发技术服务
医疗器械检测技术服务
注册人制度下体系规范与辅导
医疗器械注册申报与跟进
医疗器械生产许可或变更申请
临床评价或临床试验服务
扫描下方的二维码订阅“CIRS医械合规动态”!实时传递最新医疗器械监管法规动态,分享医疗器械注册成功经验及经典案例跟踪医疗器械最新产品安全与法规监管动态,获得最新一手资讯。

① 凡本网注明"稿件来源:“杭州瑞旭科技集团有限公司"的所有文字、图片和音视频稿件,版权均属杭州瑞旭科技集团有限公司所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本网协议授权的媒体、网站,在下载使用时必须注明"稿件来源:杭州瑞旭科技集团有限公司",违者本网将依法追究责任。
② 本网未注明"稿件来源:杭州瑞旭科技集团有限公司 "的文/图等稿件均为转载稿,本网转载出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。如擅自篡改为"稿件来源:杭州瑞旭科技集团有限公司",本网将依法追究责任。如对稿件内容有疑议,请及时与我们联系。
③ 如本网转载稿涉及版权等问题,请作者在两周内速来电或来函与杭州瑞旭科技集团有限公司联系。

