体外诊断试剂注册证申请、生产许可证申请、经营许可证申请均会涉及有关药监局对企业进行现场核查。根据相关法规依据,瑞旭技术特总结注册、生产和经营环节现场核查的重点项目。
法规依据:| 序号 | 注册环节、生产环节 | 经营环节 |
| 1 | 医疗器械生产质量管理规范及医疗器械生产质量管理规范附录体外诊断试剂 | 医疗器械经营质量管理规范 |
| 2 | 医疗器械生产企业分类分级监督管理规定 | 医疗器械经营企业分类分级监督管理规定 |
| 3 | 医疗器械生产质量管理规范体外诊断试剂现场检查指导原则 | 医疗器械经营环节重点监管目录及现场检查重点内容 |
现场核查发生的时间和条件
| 序号 | 项目 | 注册环节(以第三类注册为例) | 生产环节 | 经营环节 |
| 1 | 现场核查条件 | 1.技术审评(CFDA 或省级FDA)收到注册申请资料; 2.省级FDA收到申请人的体系核查资料 | 省级FDA接收生产许可资料并受理 | 市级FDA接收经营许可资料并受理 |
| 2 | 现场核查时间 | 省级FDA接到通知后30个工作日内完成 | 受理后,一般市级FDA在30个工作日内完成或备案之日起3个月内 | 受理后,一般县级、区级FDA在30个工作日内完成或备案之日起3个月内 |
| 3 | 涉及现场核查的具体情形 | 技术审评过程中 | 1.首次开办; 2.许可事项变更; 3.生产许可证延续申请; 4.连续停产一年以上且无同类产品在产的,重新生产时; 5.生产备案后; 6.其他常规检查时核查 | 1.首次开办; 2.许可事项变更; 3.经营许可证延续申请; 4.第三类医疗器械经营企业自行停业一年以上,重新经营时; 5.经营备案后; 6.其他常规检查时核查 |
以境内第三类医疗器械注册为例,注册体系核查大致流程如下:
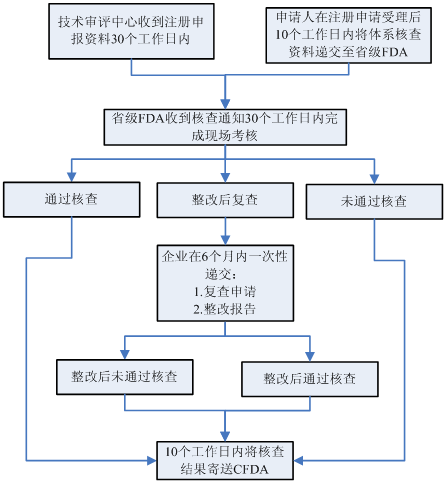
注册环节和生产环节主要针对与产品研制、生产有关的质量管理体系进行核查。详细检查项目参见《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》。注册环节质量体系核查重点针对注册检测样品和临床试验样品的真实性核查(样品生产的原材料采购、过程检验、出厂检验等记录,样品批号与生产记录批号的一致性,留样情况);生产许可环节的质量体系核查重点针对各环节的可追溯性记录和验证性文件。
可追溯性主要围绕设计和开发过程实施策划和控制的相关记录。一般主要保证以下环节的可追溯性记录,同时核查各项记录相关制度的符合性和完整性。
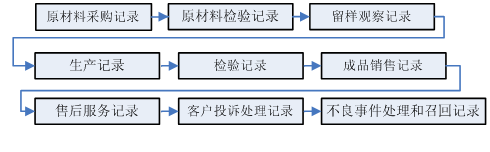
验证性文件一般主要针对主要生产工艺及反应体系的研究验证、产品性能研究验证、稳定性研究验证等。
经营环节现场检查重点内容主要依据个地方市局发布的《医疗器械经营企业现场检查验收标准》并结合《医疗器械经营环节重点监管目录及现场检查重点内容》的要求进行。重点检查主要围绕以下几方面:
| 重点检查项目 | 详细内容 |
| 合法资质 | 1.企业营业执照、经营产品的注册证、销售人员的授权书 2.供货者的医疗器械生产(经营)许可证、营业执照 |
| 仓储管理 | 检查仓储管理 1.仓库设施设备及维护记录; 2.温度日常监控记录; 3.产品存储状态是否与说明书要求一致性; 4.产品包装有否开封或破损; 5.效期预警记录。 |
| 质量追溯 | 1.计算机信息管理系统能否保证经营的产品可追溯(第三类产品); 2.供货者随货同行单; 3.进货验收记录; 4.出库复核查验记录; 5.销售记录; 6.退货产品或不合格品的处置记录; 7.说明书和标签的内容合规性。 |
| 冷链运输 | 1.设施设备是否符合医疗器械储运过程中对温度控制的要求; 2.运输方式及运输过程的温度记录等是否完整并符合规定要求; 3.计量器具使用和检定记录。 |
