截至1月10号,根据总局的报道,2017年共展开飞行检查104次,共飞检了76家医疗期器械生产企业,28家医疗器械经营企业。
去年是总局第一次对经营企业展开现场检查,主要检查对象是 III类或者 II、 III类兼营的企业。28家企业共4家体系问题严重被停业整改,主要的问题还是缺乏年度培训计划、培训记录;仓库划分不符合规范、产品混放;记录表单内容设置不全或者无销售、采购等记录表;与供应商无采购协议,缺乏供货资质审核等。
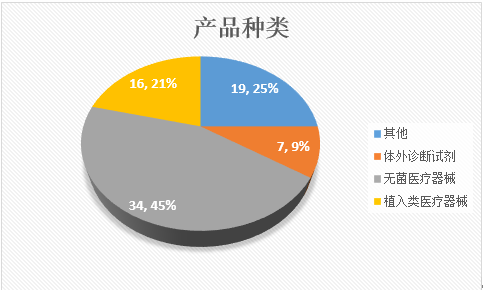
对生产企业的飞检,根据总局发布的飞行检查结果来看,共检查无菌医疗器械企业34家,植入类医疗器械16家,体外诊断试剂7家,其他产品19家,无菌医疗器械是检查的重中之重。
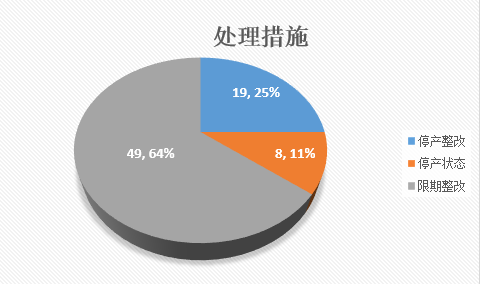
就飞检的处理结果来看,停产整改19家,限期整改49家,处于停产状态的8家,一般有严重缺陷项就会面临停产整改。
对各个被飞检的企业缺陷项进行整理归纳,缺陷项排名前十的条例如下:
违反条例 | 次数 |
《规范》第二十七条 | 28 |
《规范》第十七条 | 28 |
《规范》第二十条 | 26 |
《规范》第二十五条 | 25 |
《规范》第五十条 | 24 |
《规范》第五十七条 | 21 |
《规范》第四十三条 | 16 |
《规范》第二十三条 | 15 |
《规范》第四十一条 | 15 |
《规范》第五十九条 | 15 |
《规范》第三十七条 | 13 |
排名前三的《医疗器械生产质量管理规范》条款出现次数26~28次,近40%被查企业都犯了这几条规定,属于常见问题项,需要大家关注。
第二十七条 企业应当建立记录控制程序,包括记录的标识、保管、检索、保存期限和处置要求等,并满足以下要求:
(一)记录应当保证产品生产、质量控制等活动的可追溯性;
(二)记录应当清晰、完整,易于识别和检索,防止破损和丢失;
(三)记录不得随意涂改或者销毁,更改记录应当签注姓名和日期,并使原有信息仍清晰可辨,必要时,应当说明更改的理由;
(四)记录的保存期限应当至少相当于企业所规定的医疗器械的寿命期,但从放行产品的日期起不少于2年,或者符合相关法规要求,并可追溯。
第十七条 仓储区应当能够满足原材料、包装材料、中间品、产品等的贮存条件和要求,按照待验、合格、不合格、退货或者召回等情形进行分区存放,便于检查和监控。
第二十条 生产设备的设计、选型、安装、维修和维护必须符合预定用途,便于操作、清洁和维护。生产设备应当有明显的状态标识,防止非预期使用。
企业应当建立生产设备使用、清洁、维护和维修的操作规程,并保存相应的操作记录。
从违反的条例来看,企业最常犯的错误是表单缺失;仓库区域划分不合理,或者说即使场地划分了,但未按照划分区域来放置原料、成品等;生产设备的使用记录或校验记录缺失。
无菌附录、植入附录和IVD附录出现次数排名前三的条款分别如下:
违反条例 | 次数 |
无菌附录2.2.2 | 9 |
无菌附录2.7.2 | 7 |
无菌附录2.3.4 | 6 |
植入附录2.3.4 | 6 |
植入附录2.7.2 | 6 |
植入附录2.7.6 | 5 |
IVD附录2.3.1 | 3 |
IVD附录2.3.3 | 3 |
IVD附录2.6.5 | 2 |
相较于被检查的企业个数来看,植入附录和IVD附录前三的缺陷项实际上近一半的被查企业的都违反了,企业需要重点关注这几项条款。
飞检常见问题汇总
机构与人员
1、管理者代表对质量管理体系欠熟悉,未参加体系培训。
2、管理评审应当由企业负责人组织实施。
3、企业生产、质量与技术人员等学历、专业及工作经历与公司规定要求不符,没有培训考核评价记录。
4、规定了洁净区内进行人员数量限制要求,但没有验证记录。
厂房与设施
1、仓库未对特殊物料储存条件进行规定,缺少温度控制设施
2、温度、湿度超标
3、原料、设备、产品未分区放置
设备
1、无设备使用记录(使用、清洁、维护和维修)。
2、生产设备无状态标识。(运行、备用、修理、待修、封存、报废)
3、计量设备未标识计量有效期。
4、设备上的计量仪表有检定/校准,但没有评价是否能用或规定在实际中如何使用。
5、自校用的计量器具的精度,与被校的计量器械具精度一样。
6、传递窗紫外灯坏或闪烁,没有使用记录。
文件管理
1、记录表内容缺失较多,无法追溯
2、记录表涂改无签名和日期
设计开发
1、设计开发控制程序对设计转换缺少相关规定。
2、设计转换没有体现在设计开发文档中。
3、未考虑产品上清洗剂残留的验证。
4、风险管理未覆盖产品实现的全过程,未规定生产和生产后的外部信息收集的信息源、频次、分析和输出。
采购
1、没有按照《医疗器械生产企业供应商审核指南》的要求建立供应商审核制度。
2、未能提供原料采购标准,未按进货检验规程进行供货检验
3、未与重要供货商签订质量协议
生产管理
1、未规定特殊过程再确认要求(当过程中使用的设备,操作的人员以及过程的方法和接收准则发生了变更时,应重新进行确认。当过程的停工时间过长时或经过一定周期时,也需再确认。)
2、对消毒柜的紫外灯使用记录错误及未及时对紫外灯进行维护保养。
3、生产过程中,产品状态无标识。
4、新购置的设备未经设备验证投入使用。
5、批生产记录内容不完整
6、生产批与灭菌批关系不清楚
7、个别企业还存在现场杂乱问题。
质量控制
1、计量器具没有计量校准证据(未计量/过期/计量点不在使用范围内)
2、未按产品检验规程进行检验
3、产品检验抽样规则不明确
4、未对留样环境和样品进行检测
不合格品控制
1、不合格产品存放无标识,或存放在合格区域内
2、不合格品区和退货区没有分开,不是一个概念。
3、不合格品处理,如进行返工,应明确要求,实际操作与文件规定不一致。
不良事件监测、分析和改进
未收集与产品质量、不良事件等信息的相关记录(也要注意收集同类产品的不良事件信息)
境外现场检查
总局从2015年开始展开对境外医疗器械现场检查,但是一直以来境外现场的结果一直未公开。直到今年11月底,总局第一次发布了境外医疗器械生产企业现场检查的通报,大家才逐渐关注到境外检查。12月,总局又因为境外检查发现问题,暂停进口两进口医疗器械。
12月28日,总局针对境外检查再次发文,《药品医疗器械境外检查管理规定(征求意见稿)》发布,明年预计会有更多的境外检查的通报。
