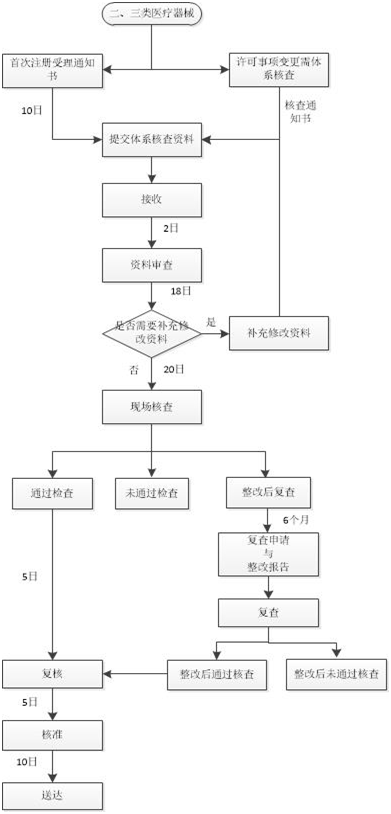
注册质量管理体系核查流程如下图:
申报资料:
(一)产品注册受理通知书复印件
(二)注册申请人基本情况表
(三)注册申请人组织机构图
(四)生产场地证明文件复印件
(五)总平面布置图、生产区域分布图
(六)对生产环境有净化要求的,还应提供有资质的检测机构出具的环境检测报告复印件
(七)产品生产工艺流程图
(八)主要生产设备和检验设备目录
(九)质量管理体系自查报告
(十)拟注册产品技术要求复印件
(十一)如属于因产品注册许可事项变更申请的体系核查,还应提交《体系核查通知》和相关注册证明文件
(十二)注册申请人资质复印件
(十三)有效版本的质量手册、程序文件
注意事项:
1.对适用于同一医疗器械体系核查标准的产品,注册申请人可合并申报体系核查资料;对适用于不同医疗器械体系核查标准的产品,注册申请人应分别申报体系核查资料;
2.在体系核查现场,注册申请人还应提供全部产品注册申报资料,包括:
(1)医疗器械(不包括体外诊断试剂):研究资料、注册检验报告、临床试验报告(如有)、医疗器械安全有效基本要求清单;
(2)体外诊断试剂:主要生产工艺及反应体系的研究资料(第三类体外诊断试剂)注册检验报告、临床试验报告(如有)。
3.在产品首次注册核查过程中,对注册检验样品和临床试验用样品的真实性进行核查。重点查阅设计和开发过程实施策划和控制的相关记录、用于样品生产的采购记录、生产记录、检验记录和留样观察记录等。
