【高分子耗材类产品临床试验及评价重点问题分析】
常见高分子耗材医疗器械- 输注类产品:如静脉输液针、输液器、注射器等。
- 体外循环类产品:膜式氧合器、人工心肺机体外循环管道等。
- 血液透析类产品如:血液透析器、血液透析用管路等。
- 其他类产品。
- 聚氯乙烯(PVC):GB15593-1995;
- 丙烯腈-苯乙烯-丁二烯共聚物(ABS):GB/T 12672-2009;
- 聚乙烯(PE):YY/T0014-2008;
- 聚丙烯(PP):YY/T0242-2007;
- 聚碳酸酯(PC):YY/T0806-2010;等。
1.相关法规、规章、规范性文件
1.1 《医疗器械临床评价技术指导原则》(总局通告2015年14号);
1.2 《医疗器械临床试验质量管理规范》(总局令第25号)
1.3 《医疗器械监督管理条例》(国务院令第650号);
1.4 《医疗器械注册管理办法》(总局令第4号);
1.5 《免于进行临床试验的第三类医疗器械目录》(总局通告2014年第13号);
1.6 《关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知》(食药监械管〔2015〕247号);
1.7 各类医疗器械注册申报指导原则。
1.2 《医疗器械临床试验质量管理规范》(总局令第25号)
1.3 《医疗器械监督管理条例》(国务院令第650号);
1.4 《医疗器械注册管理办法》(总局令第4号);
1.5 《免于进行临床试验的第三类医疗器械目录》(总局通告2014年第13号);
1.6 《关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知》(食药监械管〔2015〕247号);
1.7 各类医疗器械注册申报指导原则。
2.临床评价的定义及基本原则
医疗器械临床评价是指申请人或者备案人通过临床文献资料、临床经验数据、临床试验等信息对产品是否满足使用要求或者适用范围进行确认的过程。(《注册管理办法》第二十条 )。3.临床评价三条路径
3.1 列入《免于进行临床试验的医疗器械目录》产品的临床评价要求3.2 通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价要求
3.3 临床试验相关要求
3.1免于临床试验器械目录产品的
临床评价
对于列入《免于进行临床试验的医疗器械目录》(以下简称《目录》)产品,注册申请人需提交申报产品相关信息,与《目录》所述内容的对比资料和申报产品与已获准境内注册的《目录》中医疗器械的对比说明。
重点问题
①提供申报产品相关信息,如产品名称、结构组成、适用范围等信息,注意应包括目录中所提及内容。产品名称应与目录中一致,避免使用容易误解的名称。
②对于对比表中规定项目,不能仅有简单的对比描述,要提供相应的技术支持文件。
如提供产品结构示意图,注明各组件名称和原材料信息。②对于对比表中规定项目,不能仅有简单的对比描述,要提供相应的技术支持文件。
如产品制造材料,应提供原材料符合标准的文件等。
注明灭菌方式。
3.2 通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价要求
申报产品与同品种医疗器械的对比项目(无源医疗器械)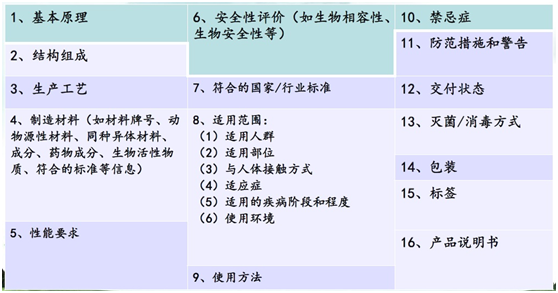
临床评价重点问题
- 基本原理:建议与同品种比对医疗器械相同。
- 结构组成:建议与同品种比对医疗器械相同,不同的结构可能会带来使用性能的变化。
- 制造材料:建议与同品种比对医疗器械相同。如使用新材料,将会影响化学性能、生物性能,以及临床使用的安全性。
- 性能要求:建议与同品种比对医疗器械相同,新的使用性能可能会影响产品的临床有效性和安全性。
- 适用范围:建议与同品种比对医疗器械相同。
- 符合的国家/行业标准:应符合强制性国家/行业标准。
- 灭菌方式:建议与同品种比对医疗器械相同。
医疗器械临床试验,是指在经资质认定的医疗器械临床试验机构中,对拟申请注册的医疗器械在正常使用条件下的安全性和有效性进行确认或者验证的过程。试验用医疗器械,是指临床试验中对其安全性、有效性进行确认或者验证的拟申请注册的医疗器械。
临床试验常见重点问题
①开展临床试验时,应尽量遵循已有注册技术指导原则进行。采用指导原则中规定的病例入选和剔除标准、安全性观察项目、有效性观察项目等。
②临床试验方案应该明确统计检验的类型、判定疗效有临床意义的界值(目标值/非劣效界值)等,界值的确定应有依据。临床试验需明确临床试验病例数、评价指标等,各中心试验方案应一致。
③如采用对照品比较,应具体说明临床试验样品规格型号、对照品生产厂家、规格型号、医疗器械注册证号等信息。
④临床试验建议选择组件最全、完成全项目注册检测型号。对照品建议选择原材料、功能等相同的已上市产品。如采用对照组比较,建议根据产品性能特点确定主要有效性指标,列明其判断标准。根据主要有效性指标计算所需病例数量,提供病例数计算公式和所有涉及参数。明确各临床试验机构试验样本量。
⑤各临床试验机构研究者应当分别出具临床试验小结,数据分析时应考虑数据完整性,采用国内外公认的经典统计方法。采用对照组比较时,建议计算相关指标统计数值,并与预先设计的非劣效界值比较,进而得出合理的统计学结论。
⑥出具临床试验总的统计分析报告、临床试验报告等文件。临床试验报告应与临床试验方案保持一致。观察项目包括有效性指标和安全性指标,报告所有不良事件发生的时间、原因、后果及与试验用器械的关系等。
⑦临床试验的产品适用范围与说明书一致。临床试验的禁忌症建议列入说明书中。
⑧补充资料中涉及临床试验的文件,提交时均应有临床机构的签章。
②临床试验方案应该明确统计检验的类型、判定疗效有临床意义的界值(目标值/非劣效界值)等,界值的确定应有依据。临床试验需明确临床试验病例数、评价指标等,各中心试验方案应一致。
③如采用对照品比较,应具体说明临床试验样品规格型号、对照品生产厂家、规格型号、医疗器械注册证号等信息。
④临床试验建议选择组件最全、完成全项目注册检测型号。对照品建议选择原材料、功能等相同的已上市产品。如采用对照组比较,建议根据产品性能特点确定主要有效性指标,列明其判断标准。根据主要有效性指标计算所需病例数量,提供病例数计算公式和所有涉及参数。明确各临床试验机构试验样本量。
⑤各临床试验机构研究者应当分别出具临床试验小结,数据分析时应考虑数据完整性,采用国内外公认的经典统计方法。采用对照组比较时,建议计算相关指标统计数值,并与预先设计的非劣效界值比较,进而得出合理的统计学结论。
⑥出具临床试验总的统计分析报告、临床试验报告等文件。临床试验报告应与临床试验方案保持一致。观察项目包括有效性指标和安全性指标,报告所有不良事件发生的时间、原因、后果及与试验用器械的关系等。
⑦临床试验的产品适用范围与说明书一致。临床试验的禁忌症建议列入说明书中。
⑧补充资料中涉及临床试验的文件,提交时均应有临床机构的签章。
附:血液透析器临床试验重点问题
①如采用对照组,一般应选择透析参数和膜材料
相似的透析器,试验组和对照组按随机原则分配。试验条件、方法步骤、临床观察等应一致。
②选择透析器膜面积小于1.5m2 、大于1.5m2的型号分别进行临床试验。
临床观察指标
①主要评价指标:肌酐和尿素氮清除率、β2-MG下降率(高通量透析器)。
②一般指标:血常规。
③生化指标:钾、钠、钙、氯、磷、二氧化碳分压、白蛋白、球蛋白、C-反应蛋白等。
④次要评价指标:整体透析肌酐和尿素下降率、超滤率等。
⑤生物相容性试验:透析开始后15min白细胞、血小板下降率。
⑥生命体征:血压、脉搏、体温、心率;
⑦副反应:低血压、过敏反应、发烧、毒血症、菌血症、败血症、其它事件等。
相似的透析器,试验组和对照组按随机原则分配。试验条件、方法步骤、临床观察等应一致。
②选择透析器膜面积小于1.5m2 、大于1.5m2的型号分别进行临床试验。
临床观察指标
①主要评价指标:肌酐和尿素氮清除率、β2-MG下降率(高通量透析器)。
②一般指标:血常规。
③生化指标:钾、钠、钙、氯、磷、二氧化碳分压、白蛋白、球蛋白、C-反应蛋白等。
④次要评价指标:整体透析肌酐和尿素下降率、超滤率等。
⑤生物相容性试验:透析开始后15min白细胞、血小板下降率。
⑥生命体征:血压、脉搏、体温、心率;
⑦副反应:低血压、过敏反应、发烧、毒血症、菌血症、败血症、其它事件等。
