“水光针”将纳入医疗器械管理
近日根据国家局医疗器械标管中心的医疗器械分类目录调整意见通知,用于面部真皮层保湿补水作用的注射用透明质酸溶液列入医疗器械分类目录中,建议按照第三类医疗器械进行管理,其中注射用透明质酸钠溶液也就是我们常见的“水光针”,据此,“水光针”或将正式纳入医疗器械管理。
2021年11月09日国家药品监督管理局医疗器械标准管理中心发布了关于征求《医疗器械分类目录》调整意见的通知,《医疗器械分类目录》内容调整意见,其中有条新增内容,具体描述如下: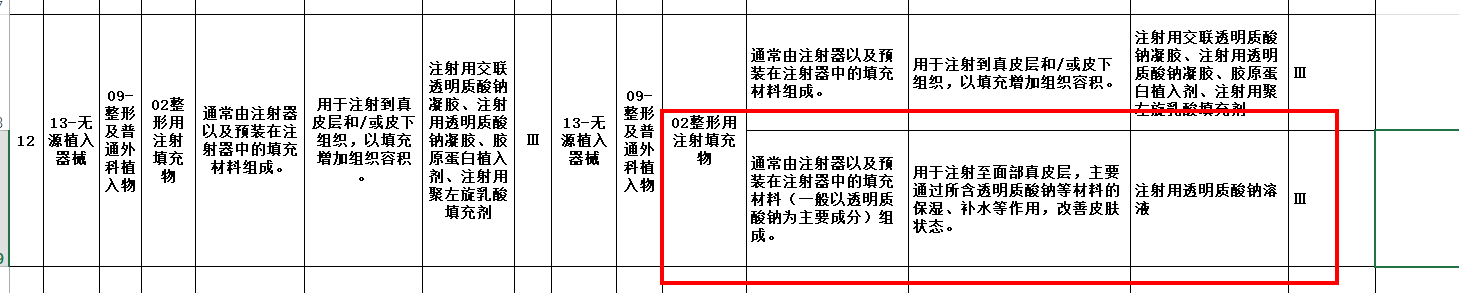
在原医疗器械分类目录13-无源植入器械,09-整形及普通外科植入物,02-整形用注射填充物中新增第三类医疗器械,例如:注射用透明质酸钠溶液,产品描述为:通常由注射器以及预装在注射器中的填充材料(一般以透明质酸钠为主要成分)组成;预期用途为:用于注射至面部真皮层,主要通过所含透明质酸钠等材料的保湿、补水等作用,改善皮肤状态。
由此我们可以发现原分类目录下,预期用途是用于注射到真皮层和/或皮下组织,以填充增加组织容积,此次目录调整将“用于注射至面部真皮层,主要通过所含透明质酸钠等材料的保湿、补水等作用,改善皮肤状态。”也归为第三类医疗器械,扩大了整形用注射填充物的预期用途。也就是说:若征求意见稿实施也就意味着医美市场上以透明质酸钠等为主要成分的,宣称保湿、补水等作用,改善皮肤状态的注射填充物也将按照三类医疗器械来监管,同时也表明这类产品必须获得第三类医疗器械注册证才能正常的生产销售流通,这意味着市面上流通的“水光针”也需要完成医疗器械的注册审批,才能上市销售。
那什么是“水光针”,怎么就要第三类医疗器械了呢?“水光针”的名称来源于韩国,其实是一种注射类的护肤疗法,注射时要借助专门的仪器“水光枪”,主要是通过将需要的美容针剂,如透明质酸等营养物质,精准注入皮肤特定层次,刺激胶原蛋白生成。注射后能使皮肤变得水润光泽而得名。
因此从解释中我们就可以看出水光针的主要成分是透明质酸钠等物质,用法是精准注入皮肤特定层次,功效是让皮肤保持水润光泽等,与新增目录条款的描述基本相符。
就算“水光针”有保湿、补水的功效,那么水光针与透明质酸钠溶液又有什么联系呐,很多人都会说我们打“水光针”里面是玻尿酸。2021年07月23日国家药品监督管理局发表的科普文章《玻尿酸,美丽背后的风险》提到“这个玻尿酸到底是个什么东东啊?” 玻尿酸的学名其实是透明质酸(Hyaluronic acid,HA),是一种细胞外基质成分,广泛分布在人和动物体内的真皮、晶状体、关节软骨等组织中。透明质酸钠是透明质酸的羧基被中和的产物,提高水溶性,易于使用,本质上与透明质酸,没有差别。
不论透明质酸还是透明质酸钠,都可以分为交联和非交联两种状态。非交联状态下在体内受到有关酶、自由基、热、机械性压力分解,相对较不稳定,维持时间相对较短,比较适合皮肤浅层注射用于补水保湿,达不到填充、除皱的要求。通常非交联的透明质酸或透明质酸钠是水光针的主成分。交联状态则是通过交联剂将游离的分子交联在一起,从而增加了对分解的耐受性,可延长有效持续时间,交联程度越高,分解速度越慢,持效时间越长。常用于皮肤真皮组织中层至深层注射,以纠正中重度鼻唇沟或皱纹,都是以交联透明质酸钠为主。查询国家药品监督管理局官网上已注册的透明质酸钠也能发现此现状。
说到这里已经不得不承认“水光针”与新增医疗器械分类目录的相关性。如果征求意见稿实施将是水光针第一次作为医疗器械接受监管。长期以来,“水光针”因其特殊性,不受化妆品监管也不受医疗器械监管。由《医疗器械分类目录》可知宣称具有填充增加组织容积的整形用注射填充物归为第三类器械。宣称保湿、补水等作用,改善肌肤状态的不作为器械监管,比如HERA透明质酸钠弹润面膜、赫妍透明质酸钠弹润眼膜等,这类产品作为化妆品管理。需要注意的是:作为化妆品管理的产品其用途为外敷或涂抹,而非通过注射使用。“水光针”的预期用途和使用方法与医疗器械或化妆品的描述均存在矛盾之处,因此并未受到有效的监管。在医美市场“水光针”的注射乱象层出不穷,比如:产品滥用,超范围、超剂量注射,对于被注射者来说存在较大的安全隐患,这必将引起监管部门的重视。近期,国家药品监督管理局频繁发出消息,重点加强整形用注射填充物产品的管理。本次《医疗器械分类目录》内容调整征求意见,监管部门也是有意将“水光针”纳入医疗器械监管。
医疗器械产品的申报,首先要确定产品的分类。众所周知,我国对医疗器械按照风险程度实行分类管理。风险从低到高分为三类。通常可以参考《医疗器械分类目录》、《医疗器械分类规则》等相关法规和文件来确定产品的分类。像菲洛嘉、润百颜、东国、LG等品牌的水光针除了以透明质酸钠、透明质酸等为主要成分外,可能还存在添加维生素、矿物质、利多卡因,甚至有些产品还添加有核酸、氨基酸、辅酶等蛋白类或具有活性的物质,对于成分比较复杂的产品,建议先申请医疗器械分类界定,或含有药品成分的建议先申请药械属性界定。先确定产品的分类,再依据具体分类制定注册方案。俗话说:磨刀不误砍柴工。“水光针”产品若正式作为三类医疗器械监管,这对生产企业将是个巨大的挑战,三类器械的注册周期长,费用高,所以请相关企业提前做好准备。
