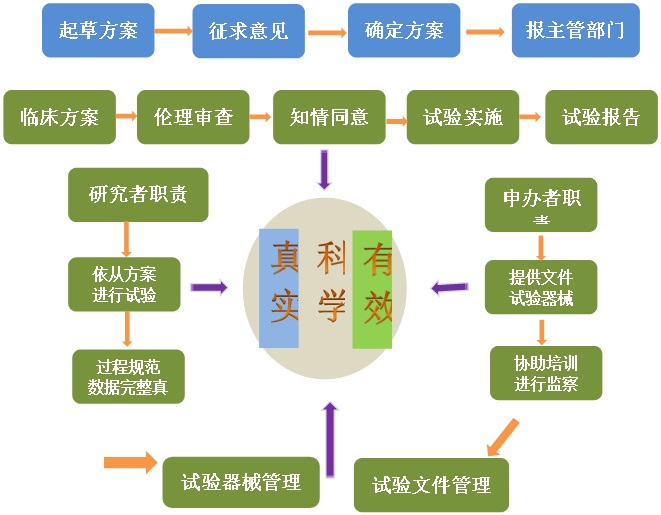
《医疗器械临床试验质量管理规范》(医疗器械GCP)从2016年6月1日起开始实施,医疗器械临床试验的开展要求遵循依法、伦理和科学三大原则。
CIRS在此对医疗器械GCP进行简要分析,主要概括其对于临床试验开展过中对于申办者和研究者的职责要求等。临床试验主要要素及过程(如图所示)
对申办者的要求
1. 选择研究者与参试单位;2. 起草签署临床试验协议、准备申请文件;
3. 起草完善试验方案、伦理审查、报备主管部门;4. 准备研究者手册、制定标准操作规程、设计病例报告表;
5. 协调试验进度、试验数据的处理和统计;6. 试验过程的监查和稽查;
7. 协助试验报告的撰写。对研究者的要求
1. 签订临床试验协议、确定研究参与人员、明确分工及责任;2. 提供良好的医疗设施、实验设备以及处理紧急情况的一切条件;
3. 组织试验方案、CRF表、知情同意书、临床试验相关SOP的撰写,邀请统计人员参与试验方案设计;4. 负责向伦理委员会提交伦理审查文件,以获得批准;
5. 负责组织临床试验的培训;6. 按照伦理批准的试验方案和相关GCP的原则实施试验;
7. 接受有关方面的监查、稽查、视察;8. 负责完成临床试验报告;
9. 负责配合申办者完成上报临床资料的答辩。另外临床试验机构应当保存临床资料至临床试验结束后10年,申办者保存至无该医疗器械使用时。对于试验用的医疗器械,申办者和试验研究人员要确保有专人管理,详细记录数量、装运、递送、接受、分配、剩余试验品处理等信息,不得销售或转交给非临床试验参与者。
临床试验还要关注以下几点:
1. 知情同意的特殊情况;2. 临床试验设计要点和评价;
3. 申办者和监查员职责任务。具体情况我们会在之后的文章里与大家一起分享。
医疗器械GCP从保护受试者权益出发,规范临床过程,保证临床试验结果真实、可靠、准确、科学和完整,是临床试验开展过程中时刻要遵守的法规基础。医疗器械临床研究者、申办者要时刻谨记医疗器械GCP的规定,牢记自己身上的责任。