- 一类医疗器械生产企业相关备案流程

- 第一类医疗器械生产企业备案相关法规:
- 2013年11月26日,国家食品药品监管总局关于印发体外诊断试剂分类子目录的通知(食药监械管〔2013〕242号);
- 2014年5月30日,关于发布第一类医疗器械产品目录的通告(国家食品药品监督管理总局令第8号);
- 2014年5元30日,国家食品药品监督管理总局关于医疗器械生产经营备案有关事宜的公告(第25号)
- 2014年7月30日,《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号);
- 2014年7月30日,《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号);
- 2014年9月26日,食品药品监管总局办公厅关于启用医疗器械生产经营许可备案信息系统的通知
- 2014年9月30日,食品药品监管总局关于印发医疗器械生产企业分类分级监督管理规定的通知
- 2015年6月29日,《药品医疗器械飞行检查办法》(国家食品药品监督管理总局令第14号)
- 第一类医疗器械生产企业申请条件
- 企业已取得第一类医疗器械产品备案凭证;
- 企业已取得工商《营业执照》在有效期内;
- 具备与所生产产品相应的生产场地、环境条件、基础设施;
- 具备与所生产产品相应的技术人员、检验仪器、管理制度、售后服务能力;
- 一类医疗器械生产企业备案提交相关资料
- 第一类医疗器械生产备案表;
- 所生产产品的医疗器械备案凭证复印件;
- 营业执照和组织机构代码证复印件;
- 法定代表人、企业负责人身份证明复印件;
- 生产、质量和技术负责人的身份、学历、职称证明复印件;
- 生产管理、质量检验岗位从业人员学历、职称一览表;
- 生产场地的证明文件,有特殊生产环境要求的还应当提交设施、环境的证明文件复印件;
- 主要生产设备和检验设备目录;
- 质量手册和程序文件目录;
- 工艺流程图;
- 经办人授权证明;
- 其他证明性材料
- 一类医疗器械生产备案凭证

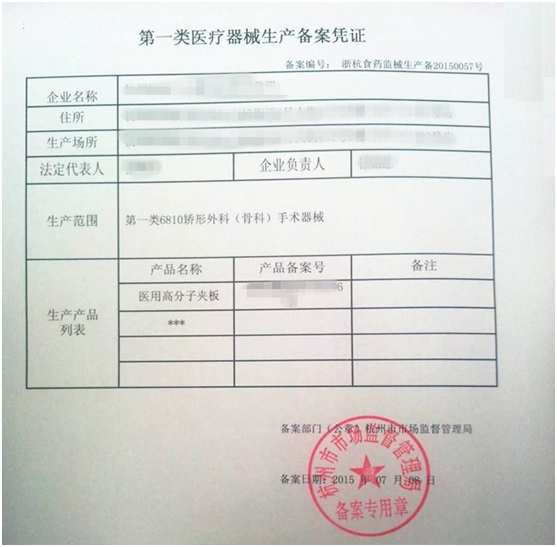
第一类医疗器械生产备案凭证的备案号编号规则为:XX食药监械生产备XXXXXXXX号。其中:第一位X代表备案部门所在地省、自治区、直辖市的中文简称,第二位X代表所在地设区的市级行政区域的中文简称,第三到六位X代表4位数备案年份,第七到十位X代表4位数备案流水号。
- 一类医疗器械生产企业监督管理
第一类医疗器械生产企业在备案后3个月内,药监局会组织进行全一次全项目检查,之后每年按一定比例进行抽查。
若在现场检查中,发现企业存在以下问题,则将对企业进行一定的处罚。
| 违法行为 | 处罚措施 |
| 利用虚假资料或其他欺骗手段取得医疗器械备案凭证 | ①向社会公告备案单位和产品名称; ②情节严重的,直接责任人员5年内不得从事医疗器械生产经营活动 |
| 医疗器械生产备案凭证若伪造、变造、买卖、出租、出借 | ①责令改正; ②处1万元以下罚款 |
| 生产无医疗器械备案凭证产品 | ①责令限期改正; ②逾期不改正的,向社会公告未备案单位和产品名称,可以处1万元以下罚款 |
| 生产不符合强制性标准或者备案的产品技术要求的产品; | ①责令改正,没收违法生产的医疗器械; ②罚款: 货值金额不足1万元,处2万~5万元罚款; 货值金额1万元以上的,处货值金额5~10倍罚款; ③情节严重的,责令停产停业,直至由原发证部门吊销医疗器械备案凭证。 |
| 未按照备案的产品技术要求组织生产,或者未按规定建立质量管理体系并保持有效运行的 | |
| 违规委托生产,或未对受托方的生产行为进行管理 |
