- GXP体系介绍 (含法规体系)
GCP:Good Clinical Practice |医疗器械临床试验质量管理规范
GMP:Good Manufacturing Practice |医疗器械生产质量管理规范
GSP:Good Supply Practice |医疗器械经营质量管理规范
GUP:Good Use Practice |医疗器械使用质量管理规范
- 医疗器械全生命周期GXP体系
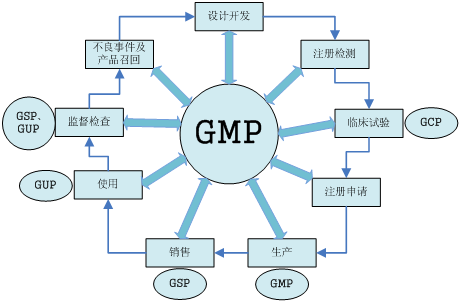

- GXP体系实施时间表
| 体系 | 名称 | 执行时间 | 备注 |
| GCP | 医疗器械临床试验质量管理规范 | 征求意见中 | / |
| 医疗器械临床评价技术指导原则 | 2014.09.11 | / | |
| 体外诊断试剂临床试验技术指导原则 | 2015.05.19 | / | |
| GMP | 医疗器械生产质量管理规范 | 2015.03.01 | 1. 2016.1.1:所有第三类医疗器械必须符合; 2. 2018.1.1:所有医疗器械及体外诊断试剂生产企业必须符合 |
| 医疗器械生产质量管理规范附录无菌医疗器械 | 2015.10.01 | ||
| 医疗器械生产质量管理规范附录植入性医疗器械 | 2015.10.01 | ||
| 医疗器械生产质量管理规范附录体外诊断试剂 | 2015.10.01 | ||
| 医疗器械生产质量管理规范现场检查指导原则 | 2015.09.25 | ||
| 医疗器械生产质量管理规范无菌医疗器械现场检查指导原则 | 2015.09.25 | ||
| 医疗器械生产质量管理规范植入性医疗器械现场检查指导原则 | 2015.09.25 | ||
| 医疗器械生产质量管理规范体外诊断试剂现场检查指导原则 | 2015.09.25 | ||
| GSP | 医疗器械经营质量管理规范 | 2014.12.12 | / |
| 医疗器械经营质量管理规范现场检查指导原则 | 2015.10.15 | / | |
| GSP | 医疗器械使用质量监督管理办法 | 2016.02.01 | / |
- GXP体系监管方式
| GXP | 监管方式 | 监管主体 | 监管对象 |
| GCP | 现场核查、监督检查、自查 | 药监局 | 临床试验机构 |
| GMP | 现场核查、监督检查、自查 | 药监局 | 生产企业 |
| GSP | 现场核查、监督检查、自查 | 药监局 | 生产企业、经营企业 |
| GUP | 现场核查、监督检查、自查 | 药监局 | 医疗机构,如医院、美容院、诊所、卫生院 |
- 如何执行GXP体系
| GXP | 如何执行 |
| GCP | 取得《医疗机构执业许可证》和二级甲等以上资质的医疗机构可以根据《医疗器械临床试验机构资质认定管理办法(征求意见)》的要求申请GCP资质 |
| GMP | 根据《医疗器械生产质量管理规范现场检查指导原则》中的具体条款: 1.若不符合项目为“*”①项,则“未通过检查”; 2.若不符合项虽仅有非“*”②项,但该项可能直接影响产品质量,则“未通过检查”; 3.若不符合项仅有非“*”项,但该项不直接影响产品质量,则“整改后复查” |
| GSP | 根据《医疗器械经营质量管理规范现场检查指导原则》中的具体条款: 1.若不符合项目为“※”①项,则“未通过检查”; 2.若不符合项目虽为非“※”②项,不符合要求的项目数比例③>10%,则“未通过检查” 3.若不符合项目仅为非“※”项,不符合要求的项目数比例≤10%,则“限期整改” |
| GUP | 医疗器械使用质量监督管理办法中规定了采购、验收、贮存、使用、维护与转让中的具体要求。 |
| 注 | ①:“*”项或“※”项 :关键项目; ②非“*”项或非“※”项:一般项目。 ③  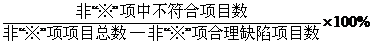 |
