医疗器械在研发、注册检测、临床试验、注册申请、取得证书后上市销售等环节,不可避免的会面临相关强制性标准更新的情况,鉴于标准发布后,会有一到两年的缓冲期才正式实施,因此在强制性标准发布后到实施前的过渡期,很多企业会纠结于如何应对。
下图为首次注册申请前、申请过程中、注册证取得后、许可事项变更(若涉及)、延续注册申请等不同时间点,强制性标准变更发布时,瑞旭技术建议企业选择的对策:
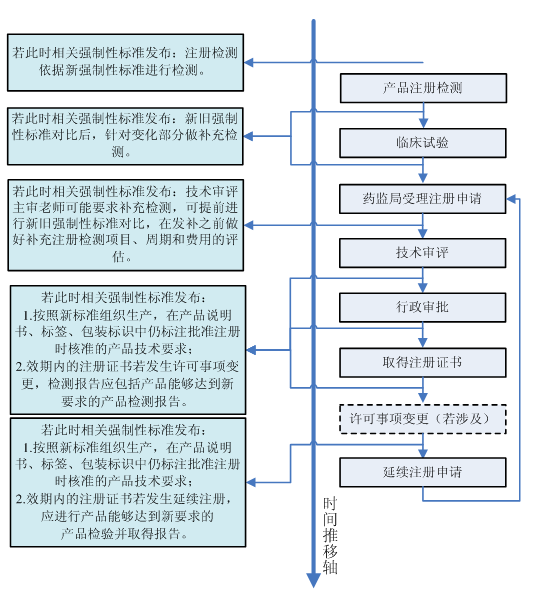
强制性标准变更的形式主要有哪些? 针对不同形式的强制性标准变化,企业具体对策是什么呢?
| 强制性标准 变更形式 | 企业具体应对措施 | 备注 |
| 增加了新项目 | 需评估检测费用及检测周期,及时针对新增部分或变化部分进行检测 | 延续注册申请须在注册证到期6个月前提交申请,因此企业应未雨绸缪,针对强制性标准已经实施的情况,相关企业应保证在注册证到效期6个月前取得变化部分的检测报告,以免延误延续注册申请时机 |
| 原有项目变化(检测方法或检测结果参考值),企业原有检测结果可能不符合新要求 | ||
| 原有项目变化(检测方法或检测结果参考值),企业原有检测结果符合新要求 | 许可事项变更注册或延续注册不需要开展符合新标准的注册检测。 | 对于许可事项变更注册,可仅针对变化的许可事项进行相应检测,不考虑新的强制性标准的要求 |
| 删除了某些项目 |
瑞旭建议:最好的做法是即使注册证刚取得不久,若相关强制性标准发布且变化形式涉及“增加新项目、“企业原有检测结果可能不符合新要求”,企业也应该主动针对变化项目进行注册检测,这样就省掉了变更注册或延续注册时的注册检测工作量。
