1. 注册申报资料哪些文件需要同时提供电子稿?
| 序号 | 文件名 | 格式 |
| 1 | 申请表 | 医疗器械申报电子软件生成的格式,医疗器械注册管理系统待启用 |
| 2 | 产品技术要求 | Word文档 |
| 3 | 仅包含技术要求性能指标部分的文件 | Word文档 |
| 4 | 综述资料 | Word文档 |
| 5 | 研究资料概述 | Word文档 |
2. 若申请注册产品不涉及某些项目,如软件研究,请问如何编排注册资料?
若产品不涉及某些项目,如软件研究,那么申报资料中“5.7软件研究”仍然需要“5.7软件研究”,内容主要要描述产品不涉及软件,不需要进行软件研究。
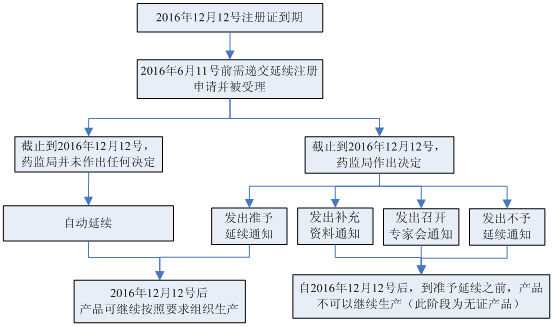
3. 对于医疗器械注册证快到期了,怎么延续?我们给大家分享过经验,那延续注册期间,注册证到期后,还能继续生产吗?
以2016年12月12号到期的第II类或第III类医疗器械注册证为例:
4.进口医疗器械受理环节注意事项
| 申报资料 一级标题 | 申报资料 二级标题 | 受理环节审查重点 |
| 1.申请表 | / | 申请表中信息与证明性文件中信息的一致性,如申请人住所、代理人住所、生产地址等信息 |
| 2.证明性文件 | 进口产品:境外上市销售的证明文件、企业资格证明文件。代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件 | 证件或文件的有效期、信息的一致性等 |
| 3.医疗器械安全有效基本要求清单 | 表格填写是否规范 | |
| 4.综述资料 | 4.1概述 4.2产品描述 4.3型号规格 4.4包装说明 4.5适用范围和禁忌症 4.6参考的同类产品或前代产品的情况(如有) 4.7其他需说明的内容 | 若为进口产品,预注册产品是否在型号规格、产品描述、适用范围和禁忌症等方面均符合进口上市证明文件中的相关描述(不可超出进口上市证明文件中的规定) |
| 5.研究资料 | 5.1产品性能研究 5.2生物相容性评价研究 5.3生物安全性研究 5.4灭菌和消毒工艺研究 5.5有效期和包装研究 5.6动物研究 5.7软件研究 5.8其他 | / |
| 6.生产制造信息 | 6.1 无源产品/有源产品生产过程信息描述 6.2生产场地 | / |
| 7.临床评价资料 | / | |
| 8.产品风险分析资料 | / | |
| 9.产品技术要求 | 需提供外文1份(生产企业签章并公证);中文2份(代理人盖章)且需写2份一致性声明 | |
| 10.产品注册检验报告 | 10.1注册检验报告 10.2预评价意见 | 检测机构是否有资质 |
| 11.说明书和标签样稿 | 11.1说明书 11.2最小销售单元的标签样稿 | 原文说明书和标签是否公证 中文说明书和标签由代理人签章即可 |
| 12.符合性声明 | 12.1声明书:符合相关法规、符合分类要求、符合国标行标。 12.2 真实性声明 | 声明书:生产企业出具 真实性声明: 1.生产企业出具 2.代理人出具 |
| 注: 1.但凡生产企业研发、生产等环节涉及的资料,均需要生产企业出具 2.生产企业签章的文件或第三方出具的文件均需公证 | ||
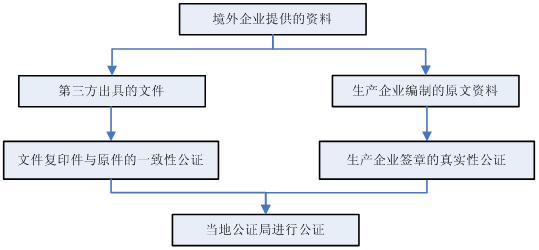
5. 进口产品资料公证?
5.1 进口生产企业出具的资料应该如何进行公证?
5.2 哪些资料需要公证?
| 一致性公证 | 真实性公证 |
| 1. 若在境外国作为医疗器械 (1) 进口医疗器械主管部门出具产品符合上市要求的证书,如FDA证书、CE证书 (2) 生产许可证或制造业许可证 (3) 商业登记证书 2. 若在境外国不作为医疗器械监管 (1) 提供相关证明文件 (2) 产品上市销售的证明文件 (3) 生产许可证或制造业许可证 (4) 商业登记证书 | 1.代理人委托书 2.医疗器械安全有效基本要求清单 3.综述资料 4.生产制造信息 5.产品风险分析资料 6.产品技术要求(外文版) 7.说明书和标签样稿(原文版) 8.生产企业出具的声明书 9.生产企业出具的真实性声明 |
| 备注: 若以下资料中包括第三方出具的资料(如检测报告复印件)和生产企业编制的资料,则需要分别进行相应的一致性公证和真实性公证: 1.研究资料 2.临床评价资料 | |
5.3 每份资料均需单独公证吗?
CFDA认可合并在一起后进行公证,故不需要每份资料均单独公证。合并公证后的公证件可以作为进口医疗器械注册申请表中所附资料“15、申请人所在地公证机构出具的原文/英文资料公证件”的资料。
6. 注册检测注意事项有哪些?
6.1 首先与有资质的检测所沟通确定:样品量、送检资料、检测周期、检测费用、预付款等信息。
6.2 准备样品、样品贴标签,编写送检资料,送检资料一般包括以下内容:
| 通用要求 | 无源产品 | 有源产品 |
| 1.产品技术要求 | 若产品涉及有效期,生产企业需提供 1. 效期验证报告 2. 效期验证报告认可申请 | 1. 关键元器件的3C认证证书等 2. 自行下载检测所要求其他资料如关键件清单、EMC送检资料 |
| 2.产品说明书 | ||
| 3.注册检测合同 | ||
| 4.委托检测合同—针对生物学评价试验 | ||
| 5.声明书—送检资料和送检样品的真实性和一致性进行声明 | ||
| 注:上述所有资料均需生产企业或代理人签章。 | ||
6.3 对于有源产品,电气安全和电磁兼容(EMC)可以同步进行吗?
一般电气安全检测的前提是电磁兼容检测合格,若企业想加快检测进度,电气安全和电磁兼容检测可以同步进行,但是若涉及电磁兼容需要整改,电气安全检测需重新检测,所以会面临电气安全已检项目费用不予退回的风险。
