《规范》的实施将有助于一些特殊医疗器械企业更好的与专家面对面沟通产品技术及注册申报事宜,确保在产品注册申报过程中少走弯路,专家咨询会的相关规程,专家公开论证会的相关规定可直接登陆CMDE官网查看。
《规范》指出,有下列情形之一的,可召开专家咨询会:
- 创新型医疗器械
- 机理不明的医疗器械
- 境内首次出现的医疗器械
- 虽然已经有同类产品在境内上市,但因材料、结构、原理、适用范围、适应症发生重大改变,现有审评依据、经验无法有效把握的医疗器械
- 其他需要技术咨询的情形
专家咨询会审批程序:
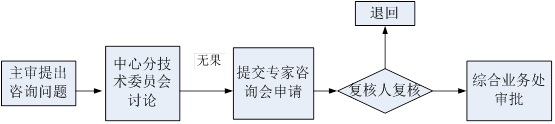
专家咨询会资料提交:
(一)需申请人参会的,在2个工作日内通知申请人需向专家咨询会提交的资料;申请人应当在回执中明确回避会议时间以及回避专家名单、理由。若申请人认为资料涉及机密,可提出申请,综合业务部与主审人沟通同意后可现场发放资料,会后收回。(二)申请人收到通知后在10个工作日内将回执寄至综合业务部,之后于20个工作日内按照要求一次性提交全部资料。
(三)综合业务部在10个工作日内若未收到回执或因申请人提供的信息错误而导致综合业务处无法发送提交专家咨询资料通知的,综合业务处可在中心外网上以公告的形式进行通知。申请人应在网上公告后20个工作日内按照通知要求一次性提交全部资料。
(四)如无特殊原因,申请人未如期提交会议资料的,由综合业务处准备会议资料,并直接安排专家咨询会。
(五)对于不需要申请人参会的,由综合业务处提供会议资料,并直接安排专家咨询会。
专家咨询会工作程序:
综合业务部收到申请人资料确认无误后,无特殊情况应在规定时间(境内30工作日,进口40工作日)内确定会议专家、时间、地点并通知申请人和有关部门。申请人因故不能参加会议的,会议照常举行。临时增加专家的由项目主审填写“临时增加专家申请表”,经复核人复核后继续执行上述程序,会议严格按照会议议程进行。
专家咨询会会议议程:
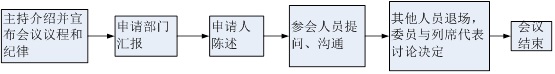
专家咨询会有关要求:
- 中心工作人员不得在召开专家咨询会前向申请人或代理人透露专家名单。
- 参加专家咨询会的人员限于参加专家和相关评审人员。如需申请人参加的,申请人方可到会介绍产品研制情况、临床试验情况,展示/演示样品,并对专家及相关评审人员提出的问题进行当场解答,但不参与专家讨论环节。
- 会议中,项目主审人应当引导专家在法规范围内评审,维持会场秩序和纪律。
专家咨询会申请表
| 受 理 号 | 产品名称 | ||||||
| 申请人 | |||||||
| 注册代理 | |||||||
| 产品概述 | |||||||
| 以往同类产品咨询情况及本次咨询必要性分析 | |||||||
| 申请 理由 | |||||||
| 是否需申请人 参会 | |||||||
| 需要咨询的问题 | 所需专家类型 | ||||||
| 签发 | 签字: 年 月 日 | 复核 | 签字: 年 月 日 | 主审 | 签字: 年 月 日 | ||
| 综合业务处负责人确认: 年 月 日 | |||||||
专家公开认证会申请表
申请会议编号:
| 会议议题 | ||
| 会议申请部门 | ||
| 需公开论证的重点问题 1. 2. 3. | ||
| 其他需说明情况(包括汇报人、列席人员等) | ||
| 分管领导意见: | ||
| 中心领导意见: | ||
| 备注: | ||
