
各有关单位:
根据国家药品监督管理局医疗器械注册审查指导原则制修订的有关要求,我中心对《可重复使用医疗器械再处理验证方法和标识注册技术审查指导原则(一)》和《可重复使用医疗器械再处理说明和确认方法注册技术审查指导原则(二)》进行了修订完善,制定了《可重复使用医疗器械再处理说明和确认方法注册审查指导原则(征求意见稿)》,经调研、讨论,现已形成征求意见稿(附件1),即日起在网上再次公开征求意见。
如有意见和建议,请填写意见反馈表(附件2),以电子邮件的形式于2023年12月8日前反馈至我中心。邮件主题及文件名称请以“《可重复使用医疗器械再处理说明和确认方法注册审查指导原则(征求意见稿)》意见反馈+反馈单位名称”格式命名。
联系人:吕英贺
联系方式:0755-8308 7056
电子邮箱:lvyh@cmde.org.cn
附件:1.可重复使用医疗器械再处理说明和确认方法注册审查指导原则(征求意见稿)
2.意见反馈表
国家药品监督管理局
医疗器械技术审评中心
2023年11月7日
如需下载原文请扫描一下二维码

可重复使用医疗器械再处理说明和确认方法
注册审查指导原则(征求意见稿)
本指导原则旨在指导注册申请人提交可重复使用医疗器械再处理说明和确认方法的申报资料,同时规范可重复使用医疗器械再处理有关内容的技术审评要求。
本指导原则是对可重复使用医疗器械再处理说明和确认方法的一般性要求,注册申请人应根据医疗器械产品特性提交相应的申报资料,判断指导原则中的具体内容是否适用,不适用内容详述理由。注册申请人也可采用其他满足法规要求的替代方法,但应提供详尽的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下、并参考了国外法规、指南、国内外标准和技术规范等制定的。随着法规和标准的不断完善,以及认知水平和技术能力的不断提高,相关内容也将适时进行修订。
本指导原则是对注册申请人和审评人员的指导性文件,不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。医疗机构进行医疗器械的再处理应同时遵守相关部门规定。
一、适用范围
本指导原则适用于可重复使用的医疗器械,主要包括以下两种情形:
(一)最初以无菌形式提供给用户,并且要求用户在首次使用后、后续患者再次使用前,进行再处理(即清洁、消毒或灭菌)的可重复使用医疗器械。
(二)最初以非无菌形式提供给用户,并要求用户进行处理(即清洁、消毒或灭菌)以供首次使用,并在每次使用后进行再处理的可重复使用医疗器械。
仅由单个患者使用,并且预期在每次使用之前需进行再处理的可重复使用医疗器械也适用于本指导原则。以非无菌形式提供,并要求用户在使用前进行处理的一次性使用的医疗器械可参照本指导原则中适用的部分。此外,按照本指导原则中的再处理说明的要求可能不足以杀灭朊病毒,注册申请人应提醒用户按照其他相关规定对预期可能与朊病毒接触的器械进行处理。
本指导原则并未针对某具体的医疗器械提供设计、测试或者再处理确认方面的建议,如有关专用指导原则针对某具体的医疗器械提供了相关建议,注册申请人应遵守专用指导原则。
二、基本原则
(一)可重复使用医疗器械的一般要求
1.设计要求
可重复使用医疗器械的设计应便于用户进行方便和有效的清洁以及必要的消毒或灭菌。一些复杂的器械设计(例如管腔内轴构造、分离器通道、精细通道、密封件和接合关节表面)对清洁和清洁确认提出了特殊要求。在器械的早期设计开发阶段,注册申请人应考虑便于进行有效再处理的设计优化(例如,将难以进行再处理的部件设计为一次性使用、设计冲洗孔、明确和/或提供专用清洁附件等)。
2.确保可重复使用医疗器械的安全性
可重复使用器械的注册申请人和用户在确保医疗器械再处理的安全性和有效性方面都发挥重要作用。注册申请人应充分明确再处理的信息,例如为用户提供再处理应采用的方法、设备、参数等信息。同时注册申请人应根据医疗器械生产质量管理规范的要求,在体系文件中保留相关再处理信息的测试文件、数据、记录等内容,证明再处理的信息已经过确认并易于用户理解且具有可操作性。
(二)再处理说明的一般考虑
再处理是将使用过的或被污染的医疗器械进行处理以满足后续使用要求的经确认的过程。再处理通常包括清洁、消毒或灭菌,清洁过程用于去除污染,消毒或灭菌用于杀灭微生物。可重复使用器械的再处理从预处理开始,通常包括以下三个步骤:
1.预处理:为了后续更好地清洁,再处理从预处理开始。预处理包含使用后及时的初步清洁步骤或措施,主要目的是防止器械内部和外部的污染物干固。
2.彻底清洁:在预处理后,应彻底清洁器械。通常,应在专用清洁区域进行彻底清洁。在使用期间可能不会被病原体污染的器械(例如血压计袖带、听诊器等)通常不需要消毒或灭菌,因此清洁后即可使用。
3.消毒或灭菌:根据器械的适用范围,器械应进行消毒或灭菌,以供再次使用。
再处理的流程概述如图1所示,附件2中提供了各再处理步骤的详细概述。在某些情形下(如器械被传染病病原体污染),在灭菌处置之前需要对器械进行消毒,这类情形不在本指导原则的考虑范围之内。
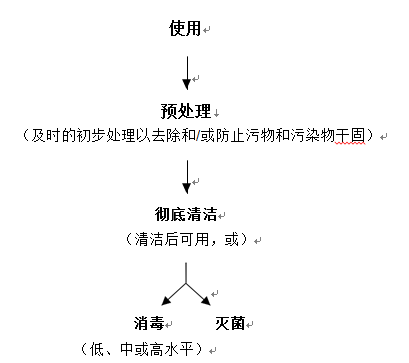
图1 流程概述
需要注意的是,清洁、消毒和灭菌是完全不同的过程。
清洁是通过物理或化学方式去除污物;所采用的清洁方法和医用清洗剂应能有效去除污物。有效的清洁应满足以下几个要求:
最大程度减少污染物在每次使用间的转移;防止残留污物在产品的使用寿命内的积聚;满足后续消毒或灭菌步骤的需要。
消毒和灭菌目的是减少或杀灭微生物,所采用的消毒或灭菌的方法和试剂应能达到相应的消毒或灭菌效果。有关消毒和灭菌的定义,请参考附件1;有关消毒和灭菌过程的具体信息,请参见本指导原则五(五)3的内容。
因此,清洁步骤应独立于消毒或灭菌进行单独确认。
三、清洁过程的确认
对再处理说明中清洁过程进行确认的目的是:该方法(手动或自动)能使器械满足进行下一步处理的要求,并最终可安全重复使用;用户应能正确理解再处理说明中的内容并执行相应的步骤。
(一)应在最不利情况下确认清洁过程
注册申请人应对其再处理说明中的清洁过程进行确认。清洁确认方案的设计应综合考虑产品的预期用途及临床使用时可能受到的污染情况(污染物种类),应包括清洁过程的最不利情况(如清洗最困难,污染最多时的状态等),并至少采用一种与临床污染物有关的定量试验方法。清洁确认方案应明确测试终点,并且能确保该器械最难以清洁的部分通过常规的清洗能够达到预期的清洁效果。对于所有试验,都应选择合理的样本量以证明试验的有效性。
1.人造污染物、接种部位和模拟使用
再处理确认中应包括完整的模拟使用测试方案。
1.1人造污染物
注册申请人应选择一种人造污染物进行测试。人造污染物的成分应能代表其在临床使用时可能接触到的污染物,并且对清洁过程最具挑战性。例如,喉镜在检查时可能会接触血液和粘液,因此,为了模拟最难以清洁的情况,人造试验污染物应为多组分污染物,其中包括模拟血液和粘液的物质。对血液或粘液进行单独的清洁确认不能代表最不利情况下的挑战,因为血液和粘液的混合物更难清洁。所选择的人工试验污染物应对至少一种具有代表性的临床相关污染物成分进行定量试验(例如,总有机碳或蛋白质)。
不建议将孢子(或任何其他微生物)对数减少试验用于确认清洁方法的有效性。关于孢子(或任何其他微生物标记)对数减少值与器械有机物污染去除效果之间的直接相关性,目前还缺少足够的科学证据。微生物的对数减少只能表明再处理过程降低了微生物的数量并不能表明其他有机物污染也降低了。
1.2接种部位
污染物接种应模拟最不利情况的临床使用条件。应在器械上所有可能接触患者材料的部位接种人造污染物,包括所有难以清洁的位置。
1.3模拟使用条件
设计清洁确认方案时,应考虑模拟使用条件,特别是对于因重复使用而导致污染物累积的器械,应采用经历过多次模拟使用后的器械。清洁效果的确认应进行多个完整的使用循环,并用于评估污染物累积情况。模拟使用循环次数应合理。
模拟使用试验过程应与实际使用状态一致,以模拟最不利情况下的临床使用条件(例如,最不利情况持续时间)。为了试验时能充分的对器械进行污染,应对器械所有预期的功能或动作进行操作(如重复连接、弯曲等),对于在临床使用时需通电、加热的器械(如电动牙科手机和高频手术器械),在模拟使用时也应同样模拟这些情况。如果在重复使用过程中会将污物推入器械中更难清洁的部位,则确认的过程应复现这种最不利的情形。如果临床使用后无法立即清洁导致污染物可能干固(例如,没有经过充分处理的外来器械),进行方法确认时应模拟污物干固的最不利情形(最长的时间)。
对照组器械应以与试验组器械完全相同的方式进行制备;阳性对照器械应被污染,阴性对照器械不得污染。
2.确认方案:测试清洁过程的方法
确认方案应明确清洁过程中的时间、温度和浓度等参数。
清洁确认方案应在清洁说明的每个步骤中明确最短时间、最低温度、最低的稀释度等,应能代表所有最不利情况下的再处理条件。且清洁确认方案应将这些最严格的条件用于清洁说明的每个步骤。注册申请人应对再处理说明中的清洁方法和确认方案中的清洁方法进行详细的并行比较,以确定和说明所有最不利情况下的处理条件。
最不利情况再处理条件的示例:
如果清洁说明建议进行10至20分钟预浸泡,确认方案应规定10分钟。
如果清洁说明建议用户在45ºC±5ºC下进行手动清洁,确认方案应规定在40ºC下进行清洁。
酶洗涤剂:一般情况下,“最不利情况”意味着最短时间、最低温度等。但酶洗涤剂例外,其通常具有“最佳有效”的温度范围。确认方案应考虑酶洗涤剂清洁说明中规定的温度范围。
医用清洁器/消毒器:如果清洁过程使用了自动清洁器/清洗消毒器或超声清洁器,则最不利情况应包括自动清洁器/清洗消毒器或超声清洁器的预期循环参数的极限值。
如果器械构成中包含必须在清洁过程中冲洗的管腔、端口或通道,则确认方案应包括最小的冲洗参数,例如时间、冲洗量或流量以及重复次数(例如,10 mL冲洗,执行 3次)。
3.试验:试验类型和方案
3.1选择试验类型
建议至少使用一种能够直接测量有临床意义的相关污染物的定量试验方法。选择试验方法时,应考虑多个因素,包括但不限于:在实际临床使用期间器械预期接触的污染物、临床相关污染物成分的试验特异性,以及试验方法与拟定清洁终点间的灵敏度。
无论选择何种试验类型,在确认过程中都应对器械的外表面和内表面进行目视检查。
注册申请人应提供试验类型的选定理由,可参考国内外相关标准、已发表的文献、已公开的测定方法等。如果注册申请人选择的试验方法与以上内容有差异,应提供相应理由(可参考GB/T 35267、YY/T 0734系列标准等)。
3.2方法确认
注册申请人应对测试污染物残留量的试验方法进行确认。试验方法应包括分析灵敏度和特异性信息,以及拟定的清洁终点,并设置对照组。
建议对照组的设置如下:
阴性器械对照:器械应未污染,并经受与试验器械相同的清洁和提取。残留污染物的量应等于或略高于阴性样本对照。
阳性器械对照:使用已知量的污染物污染器械,但不对其进行清洁,然后提取残留污染物。残留污染物应等于或稍低于所接种的污染物量。在计算时应使用污物回收率校正结果。
阴性样本对照:“提取”应在未使用任何器械的情况下进行。此样本用作空白对照。
阳性样本对照:在未使用任何器械的情况下将已知量的污染物(等于或略高于定量限度)添加到“提取物”中。
3.3提取方法
注册申请人应确认回收器械残留污染物的提取方法,并应确定回收率。确定回收率常使用极限提取和使用已知量的污染物进行提取的方法。提取应对所有表面进行采样,包括内表面(如管腔)和接合表面。在确定回收率试验时,应明确具有最不利情况挑战(最难去除)的被污染部件。应确保用于从器械中去除试验污物的提取量不过大,否则会使用于测定的试验标记物被稀释到检测水平以下。
一些器械的设计会包含在使用过程中可能被污染但在清洁和提取过程中难以接触的较复杂内部结构(例如管腔、内部移动部件)。因此,应设计清洁方法和拆卸方法以接触这些表面。对于此类在结构上较为复杂的器械,在提取方法确认和器械清洁确认中,应对所有相关的内部表面区域进行采样。因此,在确认研究中,可能需要额外的拆卸过程,以便从这些难以接触的区域充分提取残留污染物。这种额外拆卸一般不需要对基本构成组件进行进一步拆解或者破坏产品结构。
对于包含预期不与临床污染物和液体接触的内腔/内部密封结构的器械,应证明清洁液、冲洗水和/或人体的组织、体液等不会通过不完整的密封、接缝或其他内外连通气室渗入器械的内部。
如果确定存在临床污物或清洁液侵入的风险,则应证明清洁方法可满足器械使用期限内任何时候被污染的所有内部表面的清洁终点。
(二) 确定模拟使用方案的资源
建议在清洁过程的确认中使用最不利情况下的模拟使用方案。在适用的情况下,建议可咨询临床医生,以确定实际的、最不利情况下的器械污染的程度和性质。此外,在确定再处理方案时,应考虑可操作性和人为因素问题。
四、消毒/灭菌过程的确认
(一)消毒/灭菌确认流程如下图所示:
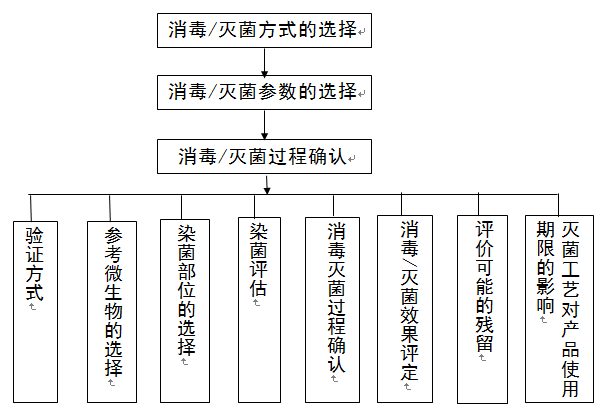
图2 消毒/灭菌确认流程图
(二)消毒/灭菌方式的选择
注册申请人应评价消毒/灭菌方式的适宜性,包括消毒/灭菌因子的适应性、对器械性能以及对器械材料的物理和/或化学等方面的影响,例如,选择高温压力蒸汽灭菌时需考虑压力变形、热塑等影响;选择化学消毒剂消毒时,需考虑化学腐蚀、材料兼容、消毒剂残留等影响。
不应使用工业灭菌方式替代医疗机构临床灭菌方式进行确认。
(三)消毒/灭菌过程参数的选择
注册申请人应对消毒/灭菌过程参数进行确认。消毒/灭菌过程参数可以是下列因素按照特定顺序的一种或多种组合:
1.消毒/灭菌因子的浓度;
2.温度;
3.作用时间;
4.作用压力;
5.湿度;
6.其他影响因素。
为保证有效的消毒/灭菌过程,若需要,应确认消毒/灭菌过程的前处理、后处理,如:
——可重复使用医疗器械消毒/灭菌前应进行的处理,如浸泡、保湿、清洁、清洗、干燥、包装、器械的数量或装载量、摆放位置、用于达到装载量的辅助器械的选择等内容;
——可重复使用医疗器械消毒后的处理,如终末漂洗、干燥、转运、存放、包装等内容;
注:干燥可结合五(五)5.11“干燥”的内容;
——可重复使用医疗器械灭菌后的处理,如存放、通风等内容。
(四)消毒/灭菌过程确认
1.确认方式
为最大限度的模拟可重复使用医疗器械的实际使用时的最不利条件,消毒/灭菌验证过程建议采用器械染菌的验证方式,不建议采用A0值、自含式生物指示物或化学指示物等其他方式进行验证。
2.参考微生物的选择
根据不同的器械的预期用途、风险水平、消毒等级、消毒/灭菌过程的抗力、器械自身生物负载的抗力等因素,注册申请人应确认参考微生物的代表性,并且微生物的抗力符合相关标准的要求。
3.染菌部位的选择
注册申请人应指定染菌部位,并阐述理由。染菌部位的选择原则应能模拟最不利的临床使用条件,并易于测试。
4.染菌评估
注册申请人应确认用于验证的可重复使用医疗器械上的参考微生物数量,如,用于消毒验证的可回收参考微生物数量应不小于1×105CFU/件,用于灭菌验证的可回收微生物数量不小于1×106CFU/件,并应规定合适的阴性对照和阳性对照。
5.消毒/灭菌过程确认
注册申请人应确认消毒/灭菌过程,并制定相应的方案,并使用挑战过程来进行确认,用以模拟临床消毒/灭菌过程中的最不利条件。通常可使用少于说明书规定的常规消毒/灭菌作用时间作为挑战,如说明书规定的常规蒸汽灭菌过程为121℃,30分钟,挑战验证工艺可选择121℃,20分钟;说明书规定的器械常规消毒过程为12至15分钟,挑战验证工艺可选择说明书中要求的最短时间,即12分钟。
确认后的消毒/灭菌参数方应标注在说明书中,注册申请人在说明书中也应注明:若使用者在使用环节对参数进行调整,如降低消毒剂浓度、增加负载数量、降低处理温度、减少处理时间,则新参数必须经过确认后方可使用。
6.消毒/灭菌效果评定
消毒/灭菌效果通过具体杀灭对数值/无菌保证水平进行评定,注册申请人应根据可重复使用医疗器械与人体接触的部位、接触污染物的种类及数量、可能导致的风险程度等因素综合考虑。
器械进行一个消毒过程后,微生物的杀灭对数值至少为3,在某些情况下应要求更高的杀灭对数值。注册申请人应根据不同的消毒水平选择适用的微生物种类和确定微生物杀灭对数值要求,并提供选择依据。
器械经已确认的灭菌方法灭菌后,无菌保证水平(SAL)应能达到 10-6。
7.评价可能的残留(如适用)
为确保器械在预期使用的安全,应评估消毒/灭菌因子在使用中或使用后,可能的残留物质对可重复使用医疗器械和患者的潜在影响,残留的消毒/灭菌因子浓度不超过消毒/灭菌剂制造商规定的水平,并应有相应的控制措施,这些措施可包括多次漂洗、加热解析、灭菌剂强制排除、强制通风等方式。
8.灭菌工艺对产品使用期限的影响
对可耐受两次或多次灭菌的可重复使用医疗器械,注册申请人应确认灭菌次数或使用期限,可以向使用者提供使用寿命终止的指标/指示物,或者提供给使用者每次灭菌后进行器械性能检验的方法和接受准则。可参考五(五)5.12项“重复使用寿命”的内容进行确认。
五、注册申报资料要求
本指导原则未提及的注册申报资料应符合《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》的要求。
可重复使用医疗器械再处理说明中的内容都应经过确认。再处理说明的确认方案和报告应在产品申报资料的“清洁、消毒、灭菌研究”中提供。
表1列举了部分难以进行再处理的医疗器械产品结构设计特征,具有符合表1产品结构设计特征的器械或表2列举的器械,在注册申报时应按照本指导原则要求提供完整的再处理说明确认方案及确认报告。对于未列入表1和表2中,但在注册申报时若有其他法规、规范性文件规定或在审评时认为需要提供完整的再处理说明确认方案及确认报告的器械,也应按照本指导原则要求提供相应的资料。对于其他情形,如基于同类/类似产品使用经验、不良事件监测、召回数据或风险管理过程的结果认为有必要的,也可参考本指导原则适用的部分提交研究资料。
(一)清洁确认方案的要求
清洁确认方案应至少包含以下内容:
1.基本信息
1.1试验产品信息
明确产品的名称、型号规格、适用范围、结构组成等。
如注册单元中包含多个型号,应说明所选取的典型性试验产品的型号以及选择的依据;
1.2清洁类型
应说明本次确认的清洁类型:手动和/或自动。清洁类型应能覆盖说明书中提供的清洁类型;
1.3清洁工具
如果注册申请人提供用于本产品的特定清洁工具,应提供完整的清单以及其作用;
1.4清洁剂
应列明本次试验所使用的清洁剂,包括名称,类型,生产商及相关的许可证编号(如适用)。清洁剂应能代表说明书中指定的清洁剂的类型,应对选择的清洁剂进行论证。
1.5清洁器
如果清洁类型为自动清洁,请列明确认适用的清洁器的名称、型号、生产商以及医疗器械注册证编号。
2.污染
2.1人造污染物
应指定人造污染物的成分,包括所有的组分以及每一个组分的浓度。人造污染物应能代表试验产品在实际临床使用过程中接触的物质,并且应最难以清洁。不建议使用微生物作为污染物,因为微生物标记物的清除不能代表有机污染物的清洁效果。注册申请人应提供人造污染物选择的论证。
2.2污染部位
应指定污染部位,污染部位应为产品最难以清洁的部分。如果有多个与人体接触的部位,建议污染所有的部位。注册申请人应提供污染部位选择的论证。
2.3污染方式
应说明如何使用人造污染物对试验样品进行污染的过程。
3.组别设置
应设置试验样品组、阴性器械对照组、阳性器械对照组、阴性样本对照组和阳性样本对照组。对照组的制备应符合本指导原则清洁过程确认部分三(一)3.2的要求。应明确每个组别设置的具体方式,包含样本量。
4.清洁方法
应明确常规清洁方法和确认用清洁方法。确认用清洁方法应采用最短时间、最低温度、最低的稀释度等最不利的条件进行。方案应对常规清洁方法与确认用清洁方法对比,说明并论证其差异。常规清洁方法应与说明书的清洁方法保持一致。
5.确认过程
5.1应明确确认的详细过程;
5.2应明确污染物残留的收集方式;
5.3应对污染物残留的收集方式进行确认;
5.4应明确污染物残留的检测指标;
5.5应明确污染物残留检测指标的测试方法;
5.6应对测试方法进行方法确认。
6.评价方法
应明确结果的计算方式以及针对指定的污染物残留检测指标,建立接受准则。注册申请人应论证接受准则的合理性。
(二)消毒确认方案的要求
消毒确认方案应至少包含以下内容:
1.基本信息
1.1试验产品信息
明确产品的名称、型号规格、适用范围、结构组成等。
如注册单元中包含多个型号,应说明所选取的典型性试验产品的型号以及选择的依据。
1.2消毒类型和消毒等级
应说明本次确认的消毒类型:手动和/或自动,化学和/或热力学消毒;消毒类型应能覆盖说明书中提供的消毒类型和消毒等级。
1.3消毒工具
如果注册申请人提供的,用于本产品特定的消毒工具,应提供完整的清单以及其作用。
1.4消毒剂
应使用已合法上市的消毒剂,同时列明本次试验所使用的消毒剂,包括名称,类型,等级(高效,中效或低效),生产商及生产商许可证编号。消毒剂应能代表说明书中指定的消毒剂的类型,应对选择的消毒剂进行论证。
1.5消毒机
如果消毒类型为自动消毒,请列明确认适用的消毒机的名称、型号、生产商以及医疗器械注册证编号。
2.接种
2.1菌种的选择
应指定确认过程中使用的菌种。菌种应对所选择的消毒类型和/或消毒剂等级最具挑战。注册申请人应提供菌种选择的依据并符合我国相关要求。
2.2接种部位
应指定接种部位,接种部位应为产品最难以消毒的部分。如果有多个与人体接触的部位,建议接种所有的部位。注册申请人应提供接种部位选择的论证。
2.3接种方式
应说明如何使用微生物对试验样品进行接种的过程。
3.组别设置
至少应设置试验样品组、阴性器械对照组、阳性器械对照组。对照组的制备应符合本指导原则清洁过程确认部分三(一)3.2的要求。应明确每个组别设置的具体方式,包含样本量。
4.消毒方法
应明确常规消毒方法和确认用消毒方法。确认用消毒方法应采用最短时间、最低温度、最低的稀释度等最不利的条件进行。方案应对常规消毒方法与确认用消毒方法对比,说明并论证其差异。常规消毒方法应与说明书的消毒方法保持一致。
5.确认过程
5.1应明确确认的详细过程;
5.2应明确微生物的收集方式;
5.3应对微生物的收集方式进行确认;
5.4应明确微生物定量分析的检测方法;
5.5适当时,说明中和方法,并对中和方法进行确认;
5.6适当时,应包括消毒剂残留评价。
6.评价方法
应明确结果的计算方式,建立接受准则。注册申请人应论证接受准则的合理性。
(三)灭菌确认方案的要求
灭菌确认方案应至少包含以下内容:
1.基本信息
1.1试验产品信息
明确产品的名称、型号规格、适用范围、结构组成等。
如注册单元中包含多个型号,应说明所选取的典型性试验产品的型号以及选择的依据;
1.2灭菌方法
应说明本次确认的灭菌方法;
灭菌方法应覆盖说明书中提供的灭菌方法;
1.3灭菌器
请列明确认使用的灭菌器的名称、型号、生产商以及医疗器械注册证编号。灭菌器应为医疗机构可使用的灭菌器。
1.4灭菌包装材料
若灭菌前需要包装,应提供正确包装的信息(如材料、成分和尺寸等)。
2.确认过程
灭菌确认过程应遵循适当的国家或者行业标准。
(四)确认再处理方法时的典型性产品选择
如设计、材料和其他因素相似,可建立产品族(例如具有一系列可用尺寸的器械组),以尽量减少再处理的确认工作。也就是说,产品族中最难再处理的器械的确认数据(即,最不利情况下的器械或“典型器械”)可涵盖再处理难度等同或更容易的器械。如果采用了这种方法,则应评价在产品族中再处理较容易的器械的所有设计特征,例如与典型代表器械的再处理挑战相关的管腔长度和直径、材料、结构和质地,并确保其与典型代表器械再处理相比挑战性较小。任何可能影响灭菌剂渗透或效力的设计或材料的变化都可能导致需要进行重新确认。如果使用了典型代表器械,则应记录相关正当理由的支持性信息。
(五)再处理说明的要求
注册申请人应提供给用户包含再处理信息的说明,即再处理说明。再处理说明应符合以下六项要求。
1.说明中应体现器械的适用范围
再处理方法应考虑器械的物理设计、适用范围以及在临床使用期间可能受到的污染情况。适当的再处理说明取决于器械是否:
仅接触患者完整皮肤;
接触患者完整的黏膜表面;
接触患者无菌组织、血液或体液(如脑脊液,腹膜液,房水等);
尽管不与患者直接接触,但由于临近患者,将可能有体液或血液的飞溅;
使用过程中,可能由于接触患者或医护人员受污染的手部而造成污染(需注意的是,未洗净戴手套的手可能将有机污物和微生物转移至其触碰的物品表面);
将因意外事件(例如患者出血、失禁、呕吐等)而导致的污染;
由于未经充分漂洗导致有害物残留,或采用了可能对器械材料或性能造成不利影响的消毒灭菌方法、试剂;
给患者或用户带来特定风险。
2.再处理说明应建议用户彻底清洁器械
应在再处理说明中明确清洁是再处理的首要环节,清洁的效果将影响最终消毒和灭菌的效果。再处理说明中应明确进行彻底清洁的方法,清洁步骤的详尽程度根据器械的复杂程度决定。
难以进行彻底清洁或者具有可能导致污染物残留的结构特征的器械在清洁时可能需要进行拆解,除非注册申请人能证明在不拆解的情况下可以完成清洁效果的确认(即,应对比在拆解状态及未拆解状态下进行清洁验证的数据)。此外,对于此类器械,清洁说明中应提供适当拆解图示及说明(详见本指导原则第五(五)5.3的要求)。
注册申请人可以选择使用保护套等措施以减少器械在清洁时的复杂度。如果使用保护套,应明确仅能使用已经合法上市的产品。同时,清洁说明应包含在未使用保护套时使用器械的情况,因为在使用过程中保护套可能受损导致失效,而保护套的破损难以识别,同时一旦发生破损情况容易对器械造成污染。
可冲洗器械(例如内窥镜,腹腔内窥镜手术器械和具有冲洗口的其他器械)容易产生污染物堆积,在清洁说明中应提供合适的冲洗方法(必要时可以配图)。充分的冲洗对于去除器械内部残留的污染十分重要。冲洗方法中应包含有关如何正确冲洗器械、需使用的相关附件(如与冲洗口尺寸适当的连接器、清洗刷等)以及用于确保有效清洁所使用的冲洗剂等内容的有关信息。
3.再处理说明应明确器械适用的消毒灭菌方法
再处理说明应符合感染控制管理规范的要求。注册申请人应根据器械的适用范围来确定相应的消毒(高、中、低水平)或灭菌方法。需要注意的是,无论采用何种消毒或灭菌方法,注册申请人都应确认其与器械的兼容以及其可有效进行再处理,并在使用说明中进行说明。再处理过程的确认应证明经再处理后能有效去除污染物并且达到预期的消毒或灭菌效果。
依据斯波尔丁分类原则,可以将器械分为高度危险性、中度危险性和低度危险性器械,并根据其可能引起的潜在感染风险程度对其需要的再处理过程给出建议。
3.1高度危险性器械
指直接进入人体血液循环系统、接触无菌组织或体腔的医疗器械。如果医疗器械达不到无菌效果可能会有微生物传播导致感染风险,应要求用户在每次使用后进行拆解(如适用)、彻底清洁并对其进行灭菌。
高度危险性器械的示例:如手术器械、穿刺针、腹腔镜、心脏导管和内窥镜活检附件。
3.2中度危险性器械
中度危险性器械是指接触完整黏膜或不完整皮肤的器械,这类器械不侵入人体组织或者人体无菌部位。尽管完整黏膜通常可以抵御少量的孢子进入,仍应通过再处理过程去除这类器械上的所有形式的微生物。应要求用户彻底清洁这些器械,然后通过灭菌对其进行再处理。如果器械设计不允许进行灭菌(例如,器械材料不能经受灭菌),则应使用高水平的消毒。
中度危险性器械的示例:如压舌板和肛门直肠压力测量导管等。
耐热器械(如硬性内窥镜)宜通过蒸汽灭菌来进行再处理。对于不耐热器械,可用“低温”再处理方式,包括过氧化氢低温等离子体灭菌、低温蒸汽甲醛灭菌、环氧乙烷(EO)灭菌和液体化学灭菌或高水平消毒等方法。
3.3低度危险性器械
低度危险性器械是与完整皮肤接触而不穿透皮肤的器械。低度危险性器械还包括不直接接触患者但在患者护理期间可能被污染(例如遭受血液、体液飞溅)的器械;视觉上看,此类器械的污染可能并不明显。应要求用户进行彻底清洁,然后根据污染的性质和程度进行中等水平或低水平消毒。
低度危险性器械的示例:如血压袖带、听诊器和皮肤电极等。不直接接触患者但在患者护理期间可能被污染的器械示例:如输液泵和呼吸机等。
在选择消毒剂时应考虑器械在临床使用中可能遭受到的最严重的污染的情况,同时消毒剂应与器械有良好的兼容性。此外注册申请人使用的消毒剂应尽可能是医疗机构中常用的。如果某些消毒剂可能会对器械造成损害,应在说明书中予以警告。
在使用期间可能不会被病原体污染的低度危险性器械(例如血压计袖带、听诊器等)通常无需消毒,清洁后即可使用;如遇有污染应及时先清洁,后采用中、低效的消毒剂进行消毒。
4.再处理说明在技术上应可行且使用合法上市的设备和附件
在预期使用环境(例如,医疗机构或家庭)中,再处理说明应具有可操作性,并明确再处理过程所需的设备和附件。例如,辐照灭菌通常仅用于生产企业灭菌而非使用者灭菌,在医疗机构中蒸汽灭菌是最常见,也可见到EO、过氧化氢、臭氧以及液体化学灭菌,但较少见到干热和化学蒸汽灭菌。
再处理说明中规定的、用于器械再处理的灭菌参数应与常用的灭菌器的经确认的灭菌参数一致。
加强循环通常包括较长的暴露时间和/或较高的温度。通常用于对复杂器械或较大负载进行灭菌。如果再处理说明中推荐使用加强循环,则应明确经过确认的循环参数及可以用于此类加强循环的附件。
5.再处理说明应全面
全面的说明使用户能够准确了解如何安全有效地实施整个再处理过程。再处理说明可以有多种格式,完整的再处理说明应包含以下所有内容。如果器械不适用于某些条款,则注册申请人在申报资料中应说明相应的不适用原因及依据。
5.1特殊附件
再处理说明应明确再处理过程中需要的附件。如果器械在再处理期间需要特殊保护(例如,使用阀门、塞子或螺旋帽以防止刺激性化学品进入),则应对其进行详细描述。再处理说明还应确定所需的任何特殊工具、刷子(包括定制化刷子)的类型和尺寸、冲洗口连接器的尺寸规格、托盘、测试工具、灭菌器附件的尺寸和类型等。说明应足够清晰以便用户可以购买正确的物品,包括任何定制的附件,或明确购买渠道。
5.2预处理
根据需要,再处理说明应包括适当的器械使用现场的预处理说明。例如,宜在清洁步骤之前在器械使用现场进行快速的预处理或采取防止污物在器械表面上干固的措施,以有利于后续的清洁操作。
一般来说,再处理过程应尽可能缩短每一步骤之间的时间间隔。过长的时间间隔可能利于微生物的生长,从而增加后续处理(如清洁和消毒/灭菌)过程的难度,因为有机污染物可能会阻止消毒剂或灭菌剂的完全渗透。
5.3拆卸和重新组装
如果器械具有可拆解的部件,则再处理说明应包括每一步拆卸和重新组装的说明,以及进行拆卸所需的工具,必要时可以使用图示、照片、视频等。此外,还应该规定对器械进行拆卸及组装的工作区域(如器械使用现场,或特定的清洁区)。
拆卸和重新组装说明应清晰明确且具有强针对性,能体现经确认的操作过程。“如适用,则进行拆卸”之类的模糊表述会将决策权留给用户,应避免使用这类的表述。如果要求在清洁之前必须拆卸器械,则应确认在需要时能够正确重新组装。为了保证重新组装后的器械可以正常使用,再处理说明应提供用户能够确认器械已正确重新组装的方法。再处理说明还应规定拆解后的器械应在灭菌之前还是之后进行重新组装。此外,在器械完全组装的状态下可能无法评估某些部件的磨损情况,拆卸和重新组装说明应告知用户在拆解状态下如何目视检查这些部件。
5.4清洁方法
再处理说明中应提供详细的、经过确认的清洁方法,该方法可以是手动的、自动的(例如,清洗消毒设备、超声波清洗器)或者两者结合。需要注意的是,某些医疗器械可能会应用在并未配备自动清洁设备的医疗机构中,这种情况下需要提供经确认的手动清洁方法。应明确每一种推荐方法所应用的参数等信息。
对于手动清洁,再处理说明应指明每个步骤的持续时间、温度、水质和其他必要条件。基于产品的设计和确认活动所需,再处理说明中可要求对器械进行重复启动、弯曲等操作。类似地,对于自动清洁,再处理说明应指明所有处理条件。再处理说明应给出具体的设备设置,如时间、温度和最大负载等。
无论清洁方法为手动、自动还是两者结合,再处理说明都应包含每个清洁、漂洗、干燥等步骤的全面的操作说明(包括图片和/或图表),以便用户可以准确地遵循这些步骤去执行。清洁剂和自动清洁设备的推荐使用说明应与清洁剂和清洁设备制造商的说明保持一致。
由于医务人员的日常活动,某些器械可能存在被患者污染物污染的风险,此类器械再处理说明中应包含医疗器械表面的清洁说明,即使仅进行简单的表面清洁,再处理说明都应该明确清洁方法、针对特定部位或材料的注意事项、拆解要求以及后续的处理步骤。需要注意的是,某些器械产品在临床使用时内部组件未被污染,但进行表面清洁时,由于与医用清洗剂或消毒剂的接触可能导致内部组件的受损,表面清洁说明中应说明如何充分清洁器械,并避免器械内部受到损害。
5.5医用清洗剂
再处理说明中推荐的医用清洗剂应是与器械相容性良好且经过确认能够达到预期的清洗效果。再处理说明中应提供制备和使用这些清洗剂的说明(例如,每千克水混合10克清洗剂),或者参考清洗剂的使用说明(例如,根据清洗剂制造商的要求)。用于特定医疗器械的说明应符合相应的清洗剂制造商的产品使用说明。
需要注意的是,某些产品(例如一些季铵化合物和醇)可用于清洁(去除污物)和消毒(微生物灭活)。而其他产品可能只能完成单一清洁或消毒作用。如果旨在进行清洁和消毒,再处理说明应明确清洁和消毒之间的区别以及每个步骤的使用方法。
5.6漂洗
再处理说明中应包含用以去除再处理过程中使用的化学残留物的漂洗说明,清洁后、使用液体高水平消毒剂和液体化学杀菌剂后应进行漂洗。漂洗可能是手动或自动。漂洗说明应提供漂洗水的类型和质量、漂洗持续时间(或漂洗次数、体积和重复次数)以及温度等参数。可以参考清洗剂的使用说明来制定漂洗说明。
经确认的漂洗说明应确保残留的清洁剂和液体化学消毒剂/杀菌剂不会干扰后续的再处理以及降低到无毒性的水平。此外,对于某些器械,应注意终末漂洗水应足以去除细菌内毒素(请注意,自来水可能含有细菌内毒素)。注册申请人可以参考当前版本的AAMI TIR34 “Water for the reprocessing of medical devices”或者WS 310.1 “医院消毒供应中心 第1部分:管理规范”,了解有关终末漂洗水的更多信息,并根据器械的适用范围确定终末漂洗的最佳水质。
此外,不建议将生理盐水溶液作为终末漂洗用水,因为生理盐水溶液可能会干扰后续消毒或灭菌步骤,也可能导致某些器械的腐蚀和无机残留物的积聚。
5.7润滑剂
使用润滑剂可以减少器械磨损和腐蚀,是延长某些医疗器械使用寿命的有效方法。如果适用,再处理说明应给出推荐的润滑剂名称或润滑剂种类(如水溶性的润滑剂),润滑剂应与医疗器械、适用范围以及后续处理步骤(如灭菌)具有良好的相容性。此外,再处理说明还应参考润滑剂的使用说明。
如果再处理说明明确要求使用润滑剂,则应在使用润滑剂的条件下确认器械再处理方法。
应谨慎使用油基和硅酮润滑剂,因为其可以覆盖和保护表面微生物,并降低某些灭菌方法(如蒸汽和EO)的有效性,甚至可以为微生物生长提供营养。
5.8目视检查
清洁说明应提供目视检查说明,可能需要使用放大设备以及照明设备。说明应要求如果在清洁步骤完成时观察到器械未完全清洁,则应重复之前的清洁步骤或者安全地废弃该器械。此外,目视检查说明应明确与器械性能相关的验收标准(例如,腐蚀、变色、点蚀、密封破裂等),以及正确处置故障器械的说明(如停止使用、废弃等)。
5.9消毒或灭菌方法
对于要进行消毒或灭菌的可重复使用器械,再处理说明应规定至少一种经过确认的杀灭微生物方法(消毒或灭菌)。杀灭微生物的方法的选择主要取决于再处理产品的类型,请参考本指导原则五(五)3的要求。
灭菌设备的规格和灭菌周期的参数因灭菌设备制造商而异,再处理说明应识别灭菌方法和类型,并且列明确认过的循环参数。传统的灭菌方法(如蒸汽和EO)已在行业中标准化,从而可以通过重要循环参数来确定灭菌周期。也可使用重要循环参数确定这些灭菌过程所需附件(灭菌容器、灭菌包装等)。
使用较新的低温化学灭菌方法(例如,过氧化氢、臭氧等)灭菌时的灭菌参数也因灭菌设备制造商而异。因此,对于这些灭菌过程,应在再处理说明中明确灭菌设备的制造商、型号和灭菌循环标识(名称或灭菌参数)。适用于这些灭菌过程的附件应由附件的制造商明确其适用的灭菌设备的制造商、型号、灭菌循环名称和/或循环参数。
对于任何灭菌方法,完整的灭菌参数应包括所有关键循环参数和其他相关信息。例如:
湿热/蒸汽:循环类型(脉动预真空或下排气)、暴露时间、温度、干燥时间
EO:EO浓度(和气体成分)、暴露时间、相对湿度、温度、通风时间
H2O2和O3:设备制造商、型号、每个型号的特定循环参数(按名称或特定循环参数标识)
干热:暴露时间、温度
再处理说明中应尽可能最大限度的提供产品设计、包装以及装载特性相关的规格信息。例如:
重量:应提供装载托盘的最大承重信息;
材料:应警示与灭菌过程不兼容的材料(如纤维素与H2O2不兼容);
设计:被灭菌器械的尺寸或特性(如管腔规格、电动的牙科手机)应与灭菌器或灭菌循环兼容;
装载:应描述装载的情况,例如,是在空载还是在满载(最差情况)下做的确认;
干燥:应告知用户在为灭菌而进行包装时,器械应是干燥的;
无菌的保持:应提供可以容许灭菌剂穿透以及保持器械无菌的包装信息,详见五(三)1.4。
5.10减少灭菌剂残留
针对某些可能在器械上残留灭菌剂的其他灭菌过程(如EO、过氧化氢等),应提供减少灭菌剂残留(例如通风)的再处理说明。
例如,对于使用EO进行灭菌的器械,说明中应给出建议的通风时间,以将EO残留减少到可接受的水平。有关EO通风的建议,可以参考YY/T 1544 “环氧乙烷灭菌安全性和有效性的基础保障要求”、WS/T 367 “医疗机构消毒技术规范”和AAMI ST41 “Ethylene Oxide Sterilization in Health Care Facilities: Safety and Effectiveness”等内容。(有关可接受EO残留水平的更多内容可以参考GB/T 16886.7及GB 18279系列等相关标准)。
5.11干燥
在高水平消毒或液体化学灭菌后,器械有可能有液体附着,干燥步骤可以减少或消除未包装器械的再污染。再处理说明中应给出推荐的干燥方法,这样可以降低被微生物污染的风险。再处理说明中还应建议经过确认的最短干燥时间。再处理后驻留在产品上的水分可能会损害包装材料的无菌屏障属性和密封的有效性,从而损害包装的完整性和密封性。
中途干燥(即,清洁后的干燥)是另一个需要重点关注的因素,因为在器械上残留的水分可能会干扰后续再处理过程。如果后续再处理过程在清洁后的一段时间才进行,那么再处理说明中应该给出建议的有效的中途干燥方法,以满足后续再处理的需要。
5.12重复使用寿命
再处理说明应基于验证结果告知用户产品可使用的次数;或向用户提供用于确定器械是否已经超过其使用寿命的方法。在后一种情况下,应给出确定该器械仍然满足其性能指标(适用范围)的方法;同时,若其不能满足,也应给出适当的处理方法。例如:
说明器械设计特性,如内置的自动预检功能;
说明重新使用之前应通过的测试内容;
说明目视检查的验收标准(例如不可接受的恶化,如腐蚀、变色、点蚀、密封破裂)。
无论选择哪种方法,再处理说明应针对如何评估复杂器械中难以直接观察到的区域的老化程度给出建议,特别是管腔内的老化(例如可采用泄漏试验)。
重复使用寿命应综合考虑产品可以耐受的再处理及重复使用的次数来确定,并在再处理说明中给出。如果再处理过程对器械的重复使用寿命起到决定性作用,则再处理说明中应给出产品可耐受再处理循环的次数,并应提醒用户该有限次重复使用循环取决于是否完全遵守该器械的使用说明。
5.13其他建议
最初以非无菌形式提供给用户,并且要求用户在首次使用前进行灭菌的产品,需要在每个产品的独立包装上(而非仅仅在运输包装上)对其非无菌特性进行显著地标识以确保在使用前完成了灭菌。在需要进行再处理时,应提供有关再处理过程的所有警告及注意事项。这些可能与用户再处理的有效性及产品性能或使用者安全有关。例如,一些器械可能具有未密封缝隙,消毒过程中,过量的液体消毒剂可能通过缝隙进入器械内部并损坏器械。在这种情况下,说明应警告用户这种潜在的危险,并提供具体的使用说明来防止这种危害。例如避免使用过量的液体消毒剂等。宜告知用户发生何种损坏可能会影响到再处理过程。
5.14患者或非专业人士使用
旨在由患者或非专业人士(例如,家庭成员或其他人)使用的器械,再处理说明应易于理解并且可在相应的使用环境中(如家庭)进行再处理。执行再处理所用的各种设备及附件也应在预期使用环境中易于获得。
5.15参考内容
除本指导原则中拟定的建议外,可重复使用器械再处理说明还可向用户提供额外的参考标准或规范,但不得代替已确认的再处理说明。再处理的要求以注册申请人提供的说明书指示信息为准。
只要所参考的标准与规范与可重复使用器械的再处理说明不冲突,就可用于器械的再处理。例如,《软式内镜清洗消毒技术规范》和《口腔器械消毒灭菌技术操作规范》等可以供相应医疗器械的再处理作为参考。
6.再处理说明应易于理解
再处理说明应清晰、易读(如:字体大小应合理)、并遵循一定的逻辑顺序,即应顺次从初始再处理步骤至最终步骤,例如预处理、拆卸、清洁、漂洗、干燥、重新组装、消毒或灭菌、消毒或液体化学灭菌后的终末漂洗以及后处理(干燥、解析等)。再处理说明应尽可能用简单易懂的语言,并且详尽地对每步操作进行准确的解释。图示、图解有助于用户理解和执行再处理说明,同时应附有相应的说明文字以确保用户能够理解并遵守。
六、参考文献
[1]FDA. Reprocessing Medical Devices in Health Care Settings: Validation Methods and Labeling Guidance for Industry and Food and Drug Administration Staff[Z].USA : FDA,2017.
[2]ISO 17664-1:2021,Processing of health care products — Information to be provided by the medical device manufacturer for the processing of medical devices — Part 1: Critical and semi-critical medical devices [S].
[3]ISO 17664-2:2021,Processing of health care products — Information to be provided by the medical device manufacturer for the processing of medical devices — Part 2: Non-critical medical devices[S].
[4]YY/T 0802-2020,医疗器械的灭菌 制造商提供的处理可重复灭菌医疗器械的信息[S].
[5]GB 15982-2012,医院消毒卫生标准[S].
[6]GB/T 15981-2021,消毒器械灭菌效果评价方法
[7]WS/T 367-2012,医疗机构消毒技术规范[S].
[8]WS 507-2016,软式内镜清洗消毒技术规范[S].
[9]WS 310.1-2016,医院消毒供应中心 第1部分:管理规范[S].
[10]WS 310.2-2016,医院消毒供应中心 第2部分:清洗消毒及灭菌技术操作规范[S].
[11]WS 310.3-2016,医院消毒供应中心 第3部分:清洗消毒及灭菌效果监测标准[S].
[12]YY 0734.1-2018,清洗消毒器 第1部分:通用要求和试验[S].
[13]AAMI TIR30:2011(R2016),A Compendium Of Processes, Materials, Test Methods, And Acceptance Criteria For Cleaning Reusable Medical Devices[S].
[14]AAMI TIR12:2020 Designing, Testing, And Labelling Medical Devices Intended For Processing By Health Care Facilities: A Guide For Device Manufacturers[S].
[15]GB/T 16886.7-2015,医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量[S].
[16]国家药品监督管理局.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告:2021年第121号公告[Z].
【附件1】
名词解释
生物指示物:将适当载体染以一定量的特定微生物,用于指示消毒或灭菌效果的制品。
清洁:去除物品上的污物和污染物,使之达到可进一步处理或适用范围所需的程度。
消毒剂:用于杀灭传播媒介上的致病微生物使其达消毒或灭菌要求的制剂。消毒剂破坏的是公认程度最高的致病微生物,但不一定涵盖所有微生物形式,如细菌芽孢。
消毒:通过物理或化学的方法清除或杀灭传播媒介上致病微生物,使其达到无害化的处理。消毒过程不能确保与灭菌过程相关的相同安全幅度。根据消毒剂的性质,消毒过程的致死率可能有所不同,从而使消毒剂的性质分为以下子类别:
高水平消毒:在低于灭菌条件下使用灭菌剂的致死过程。除了大量的细菌芽孢,该过程可杀死所有形式的微生物。
中水平消毒:使用可杀死病毒、分枝杆菌、真菌和细菌繁殖体但无法杀死细菌芽孢的药剂的致死过程。
低水平消毒:仅能杀灭细菌繁殖体,一些真菌和亲脂性病毒的致死过程。
灭菌剂:能够杀灭一切微生物,达到灭菌要求的制剂。
过程确认:通过客观证据确定过程可始终产生满足其预定规格的结果或产品。
再处理:为满足后续单次使用要求,用于处理新的或使用过的医疗器械经确认的过程。这些过程包括清洁、消毒和灭菌。
可重复使用医疗器械:用于在相同或不同患者上重复使用的器械,其中,在使用间应进行适当的清洁和其他再处理
一次性使用器械:仅供单次使用,或在单个手术期间用于单个患者的器械。
孢子:微生物(通常是细菌或真菌)的休眠状态,其表现为生物合成活性、降低呼吸活性等的缺乏,并具有对热、辐射、干燥和各种化学试剂的抗性。
无菌:无存活微生物。
无菌保证水平(SAL):灭菌后单位产品上存在单个活微生物的概率。通常表示为10-n。
灭菌:使产品不含有活性微生物的经确认的过程。
注意:在灭菌过程中,微生物灭活的规律用指数函数表示,因此,任何单件产品上的微生物存活率可以用概率来表示。虽概率可以降低到很低,但不可能降为零。
灭菌包装:灭菌包装(灭菌袋或灭菌用附件)用于封装医疗服务人员打算进行灭菌的医疗器械。目的为允许对封装的医疗器械进行灭菌,并且在使用前维持封装器械的无菌性。
【附件2】
可重复使用医疗器械再处理概述
下图所示为一般再处理步骤的过程概述,对可重复使用医疗器械进行适当的处理和再处理以供下一次使用。
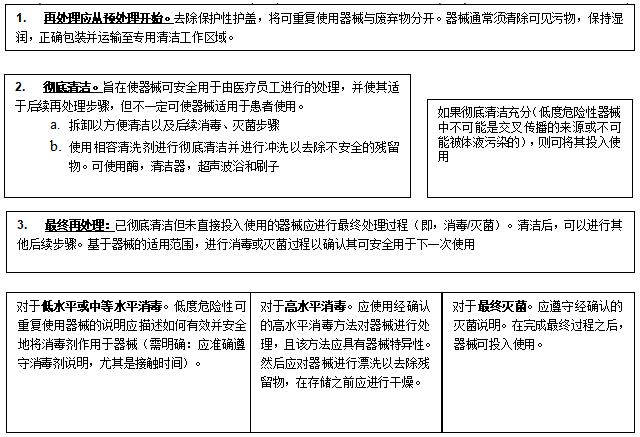
图3过程概述
【附件3】
表1 部分难以进行再处理的医疗器械产品结构设计特征
【附件4】
表2 高度关注的产品目录
#相关推荐#
