9月18日,FDA对化妆品的工厂注册和产品清单登记系统拟收集的信息开启意见征求,包括公开电子提交门户(Cosmetics Direct)页面,以及两类纸质提交表格(FDA表格5066和5067)的草稿发布。意见征集截至2023年10月18日。
一. 电子提交门户
名称被定为Cosmetics Direct,与药品注册平台CDER Direct同属于FDA Direct。页面展示如下:
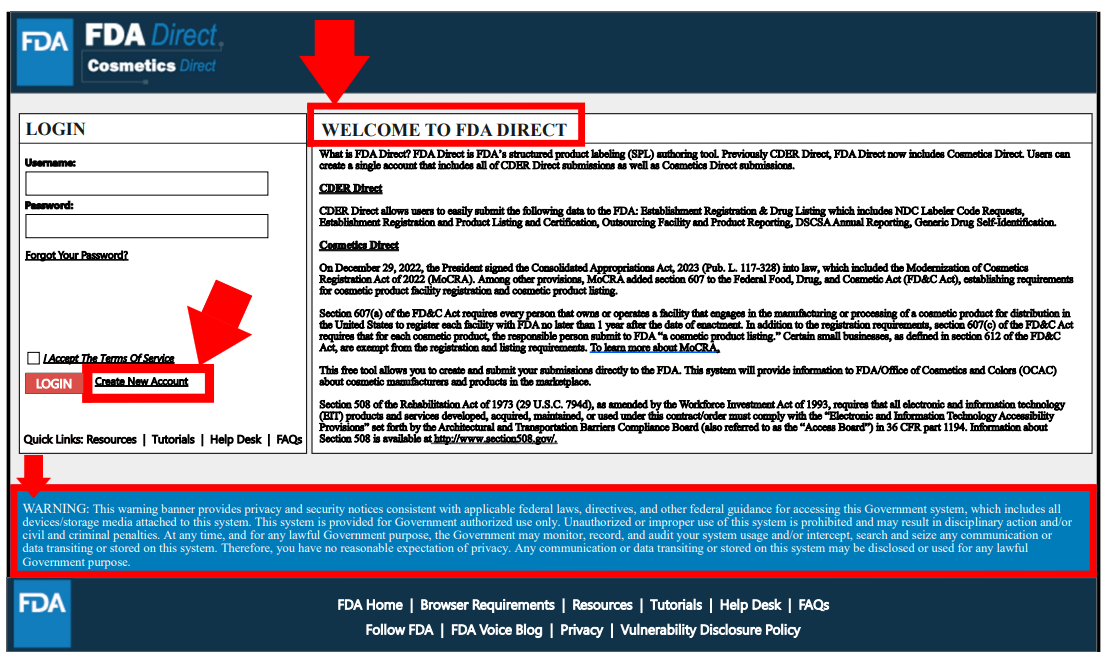
创建账户
3种形式,可以创建独立的CDER Direct或COSMETICS Direct账号,也可同时开通两者。但仅创建Cosmetics Direct账户的无需提供邓白氏码(DUNS Number)。该过程需提交机构名称、地址、联系信息等。图中标星号为必填项。
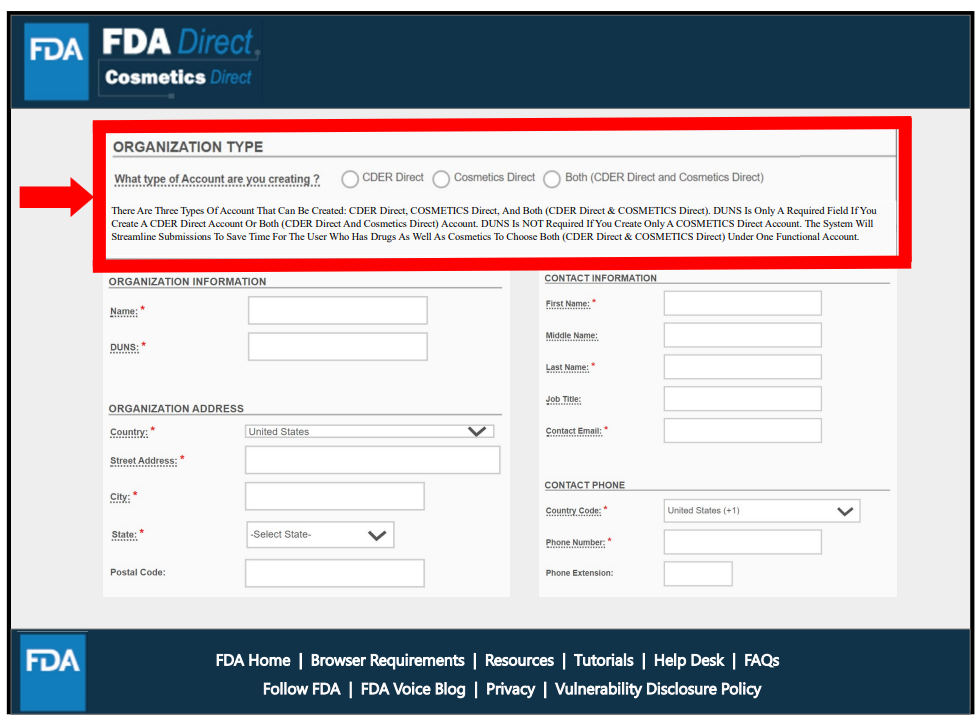
Cosmetics Direct主页面包括注册登记入口(可进行设施注册以及产品清单登记)、注册登记记录以及相关的FDA链接。
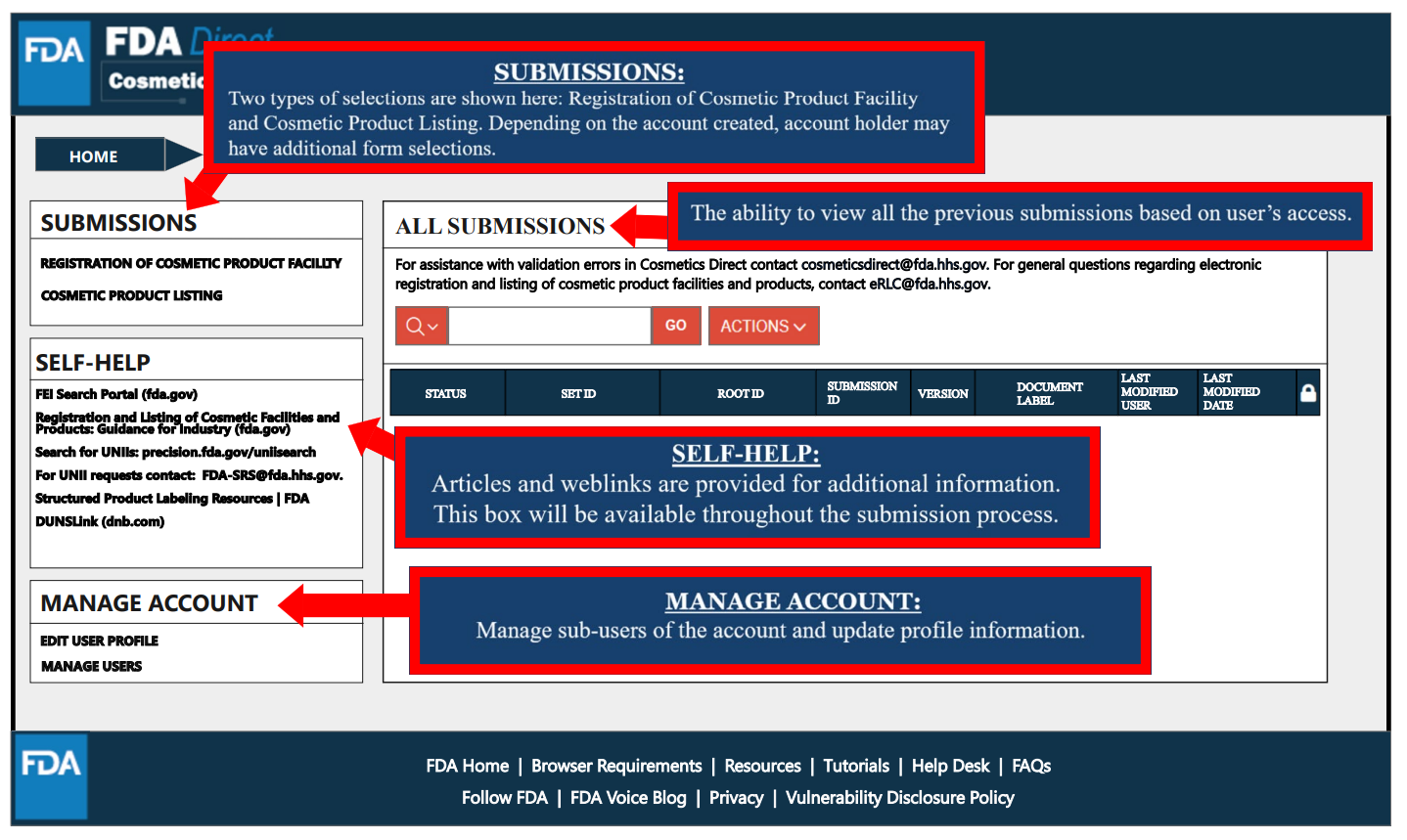
设施注册/工厂注册
在“SUBMISSIONS”处选择设施注册,出现以下页面,可选择在平台上创建电子表格或上传SPL文件。
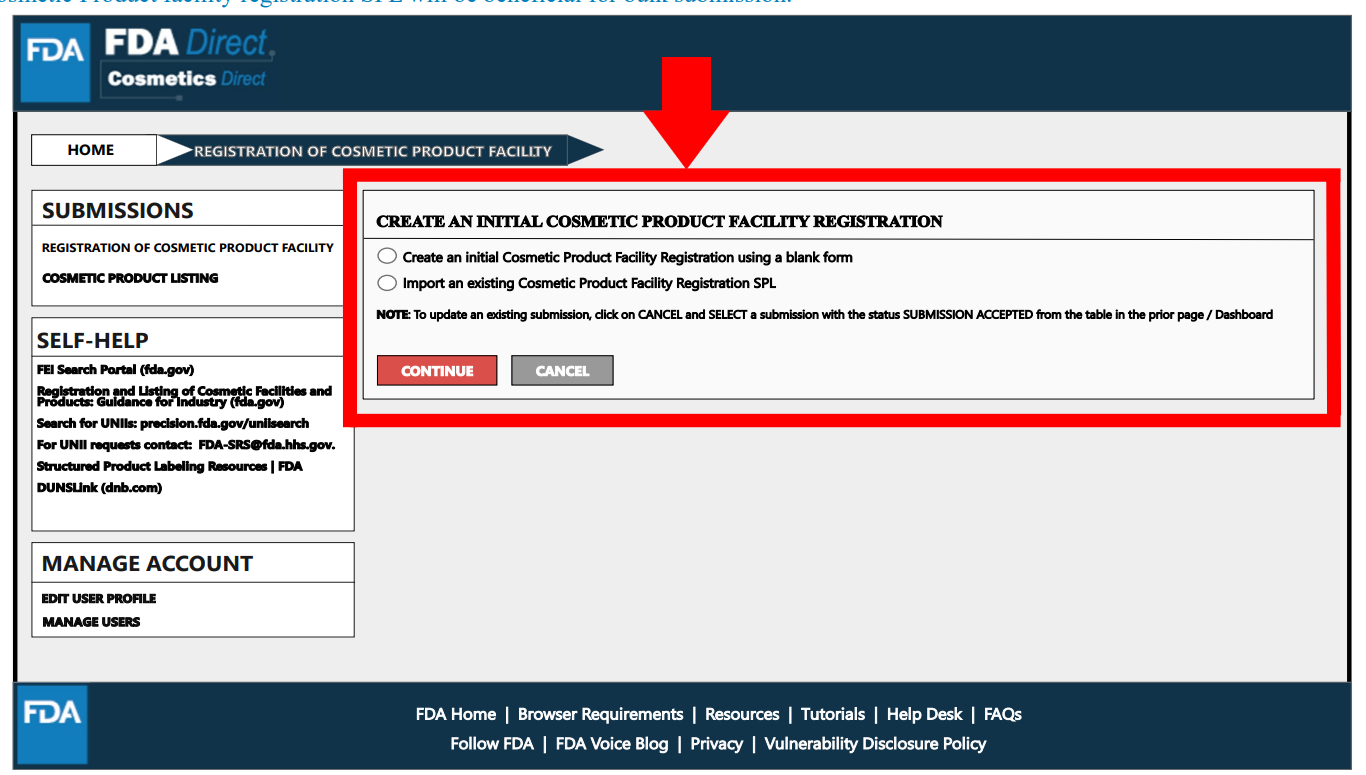
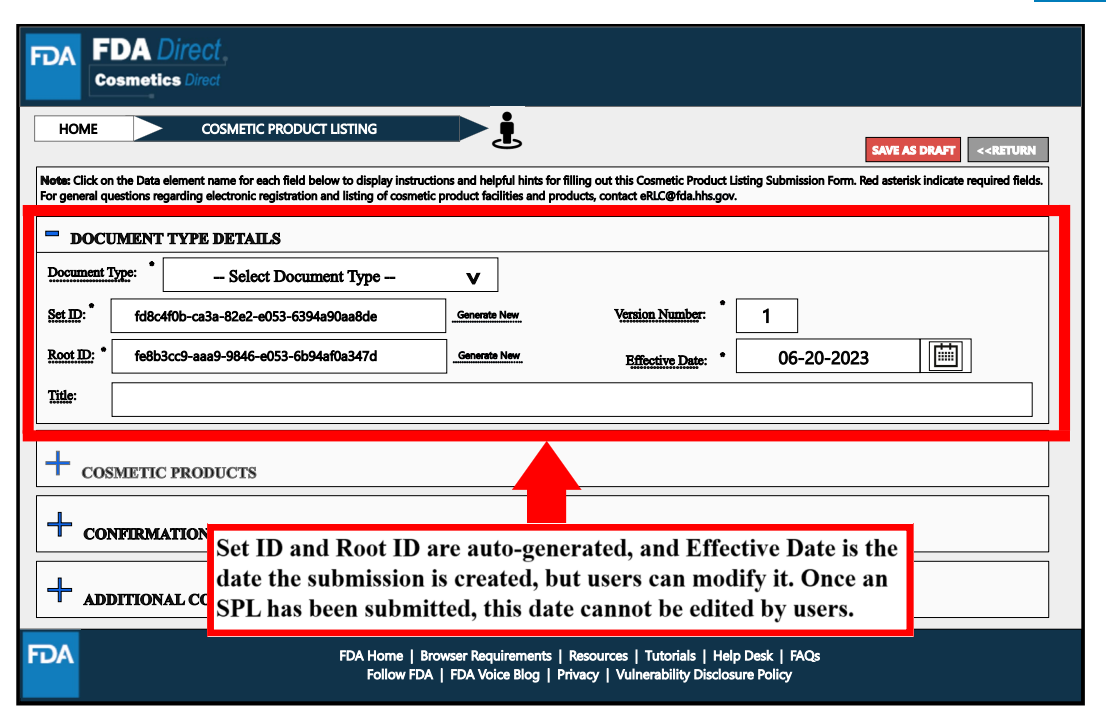
选择在平台上创建电子表格后出现信息提交页面。其中,在Document Type Details处,Document Type是指企业注册类型;Set ID和Root ID是系统自动生成的,Set ID是标识唯一的SPL文件,当提交的SPL发生变化时,新的Root ID会分配给新的SPL;生效日期是提交创建的日期。
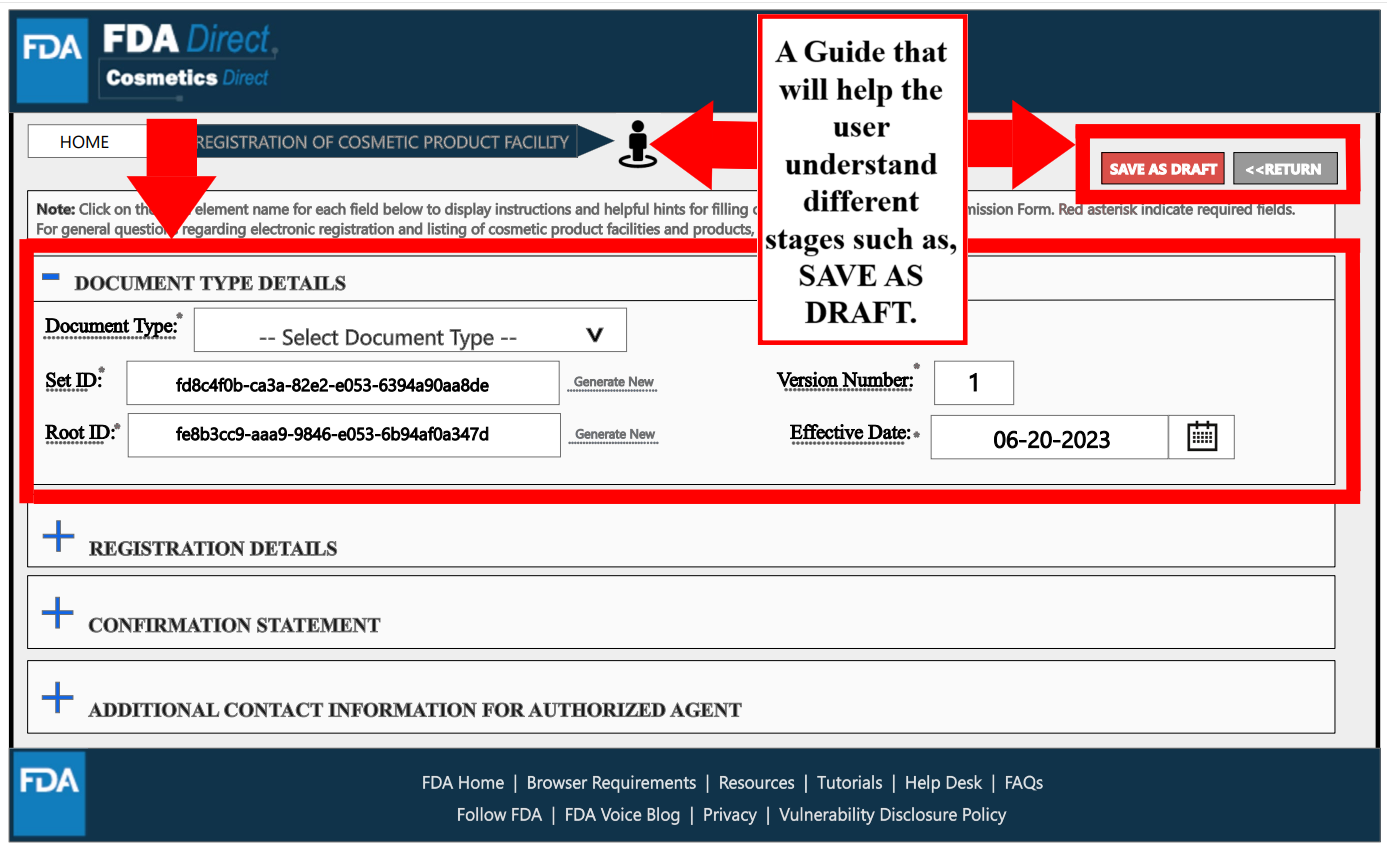
在Registration Details处,红色框中标星号的是必填项,包括工厂名称、FEI号(属于豁免注册的工厂且没有FEI号,可以提供企业名称和地址)、工厂联系信息。
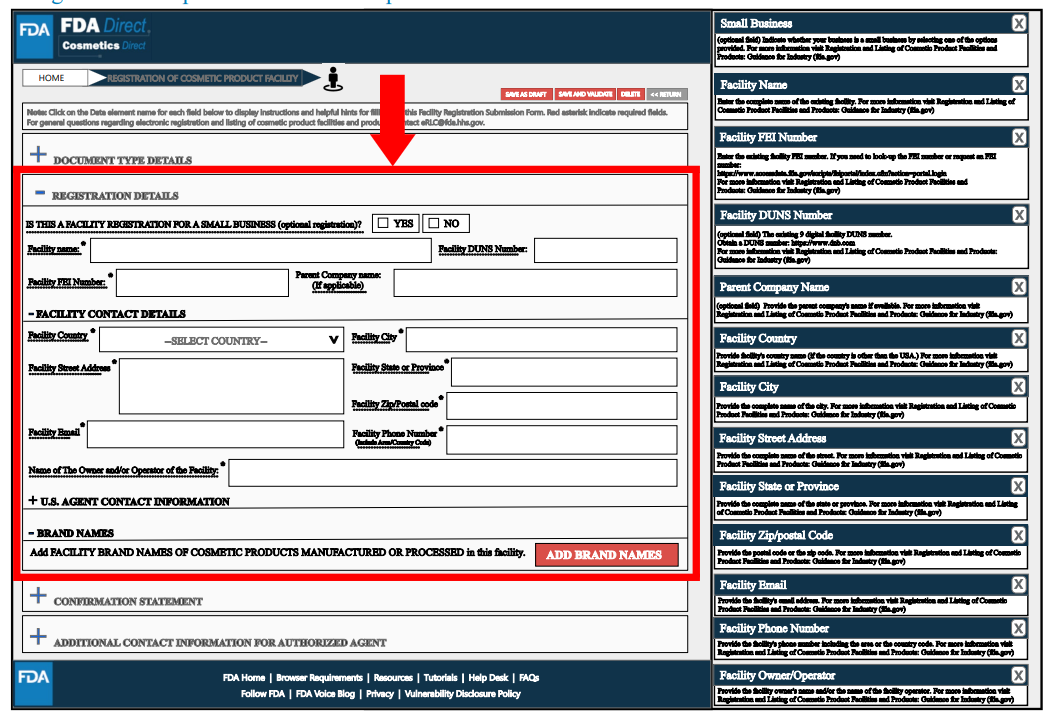
此外,还需要填写美国代理人的信息和联系方式。
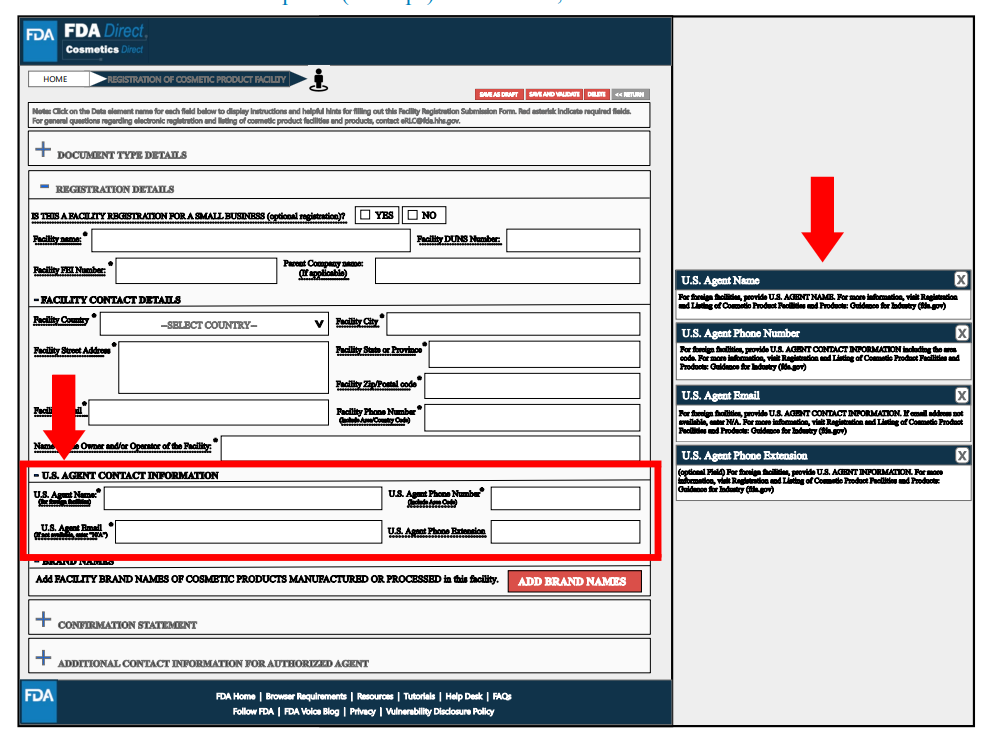
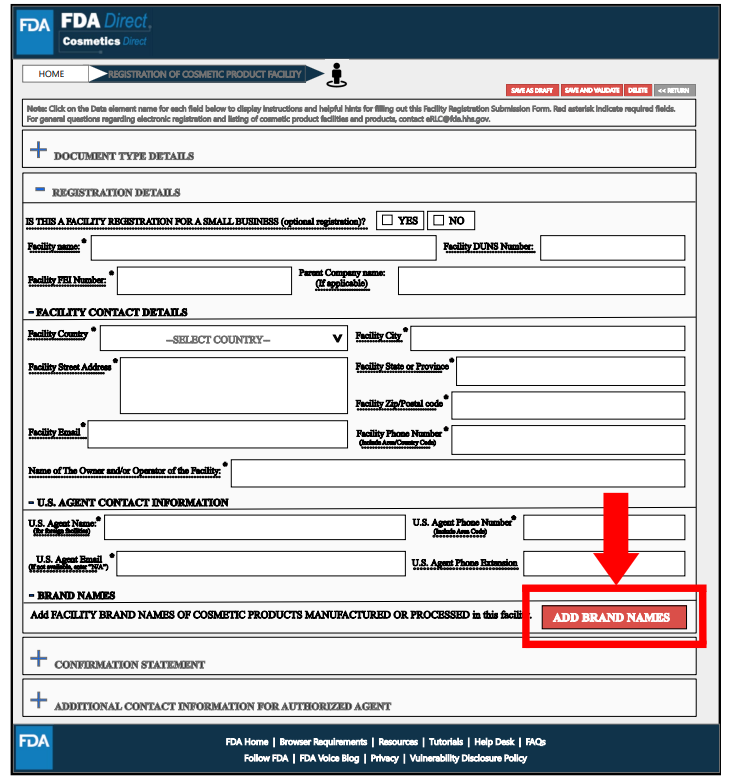
在Brand Name(s)处,通过选择“添加品牌名称”提交在该工厂生产或加工的化妆品品牌名称,并选择适用于此品牌名称的所有类别代码。可以提交多个品牌信息。
Confirmation Statement处,了解确认声明后,选择“同意”;随后进行签字确认。

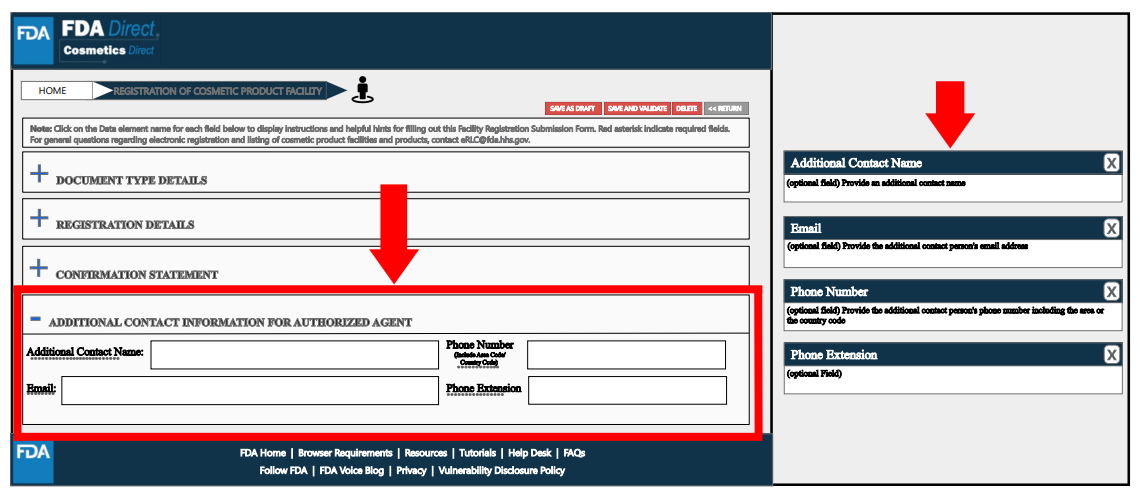
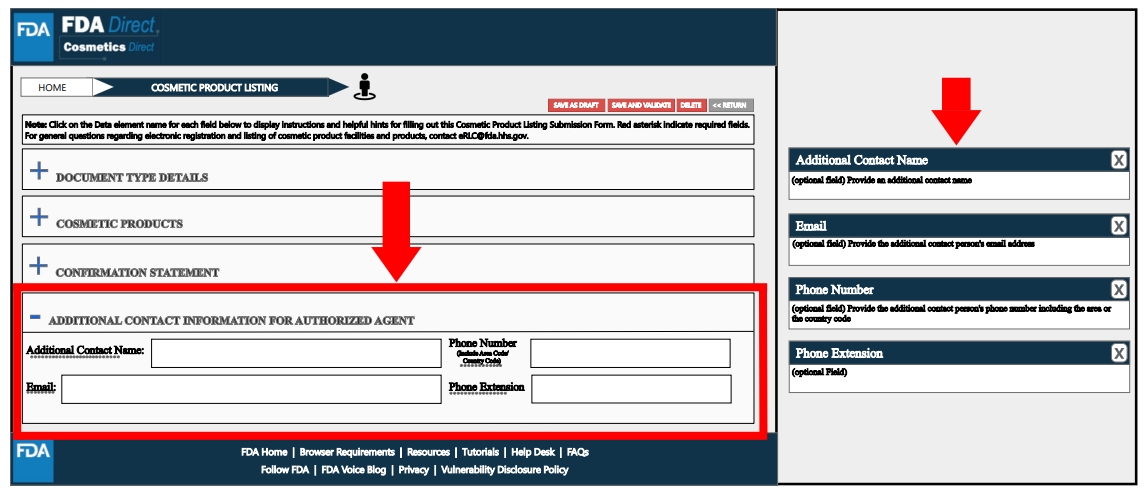
Additional Contact Information for Authorized Agent处,根据工厂实际情况填写相关信息,如附加的联系人名称、电话、电子邮箱等。
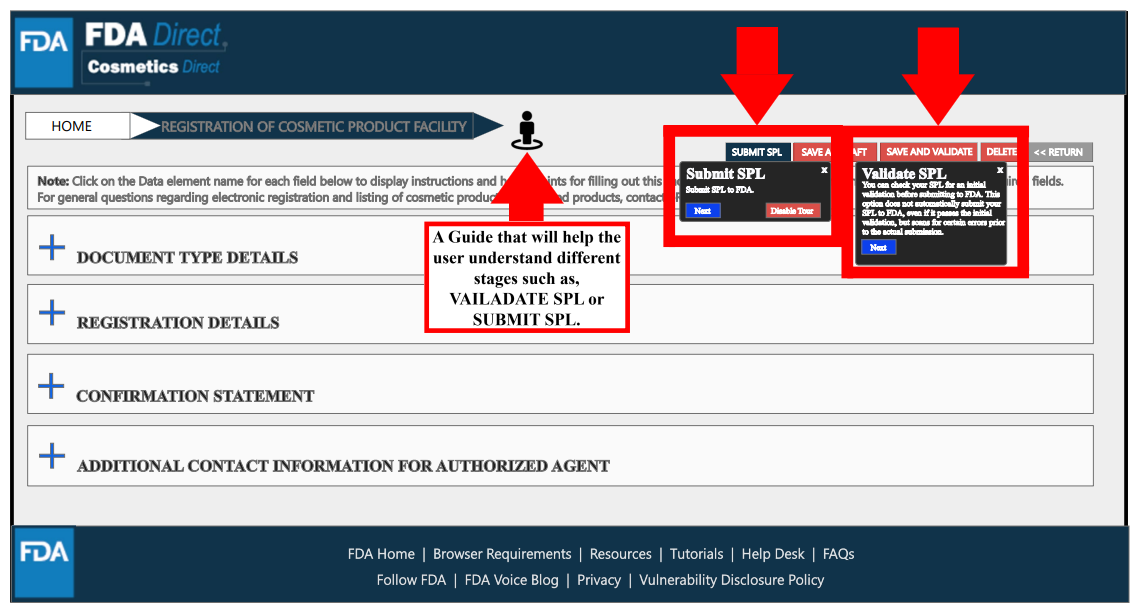
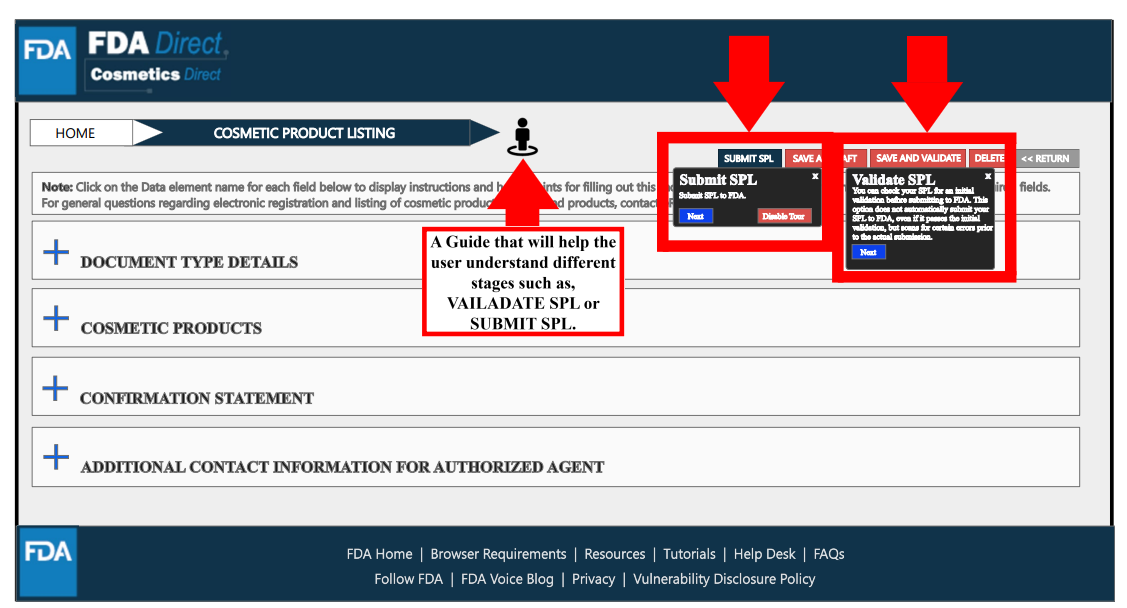
 在填写所有必要信息后,选择“保存和验证”以识别任何错误,或是选择“提交SPL”以将表单提交给FDA。
在填写所有必要信息后,选择“保存和验证”以识别任何错误,或是选择“提交SPL”以将表单提交给FDA。
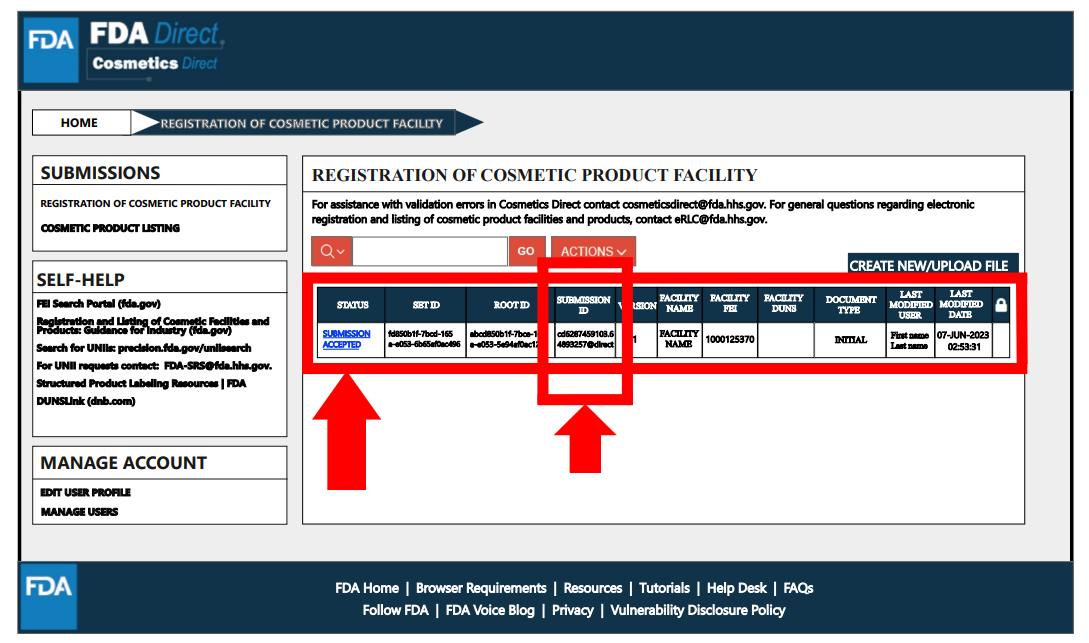
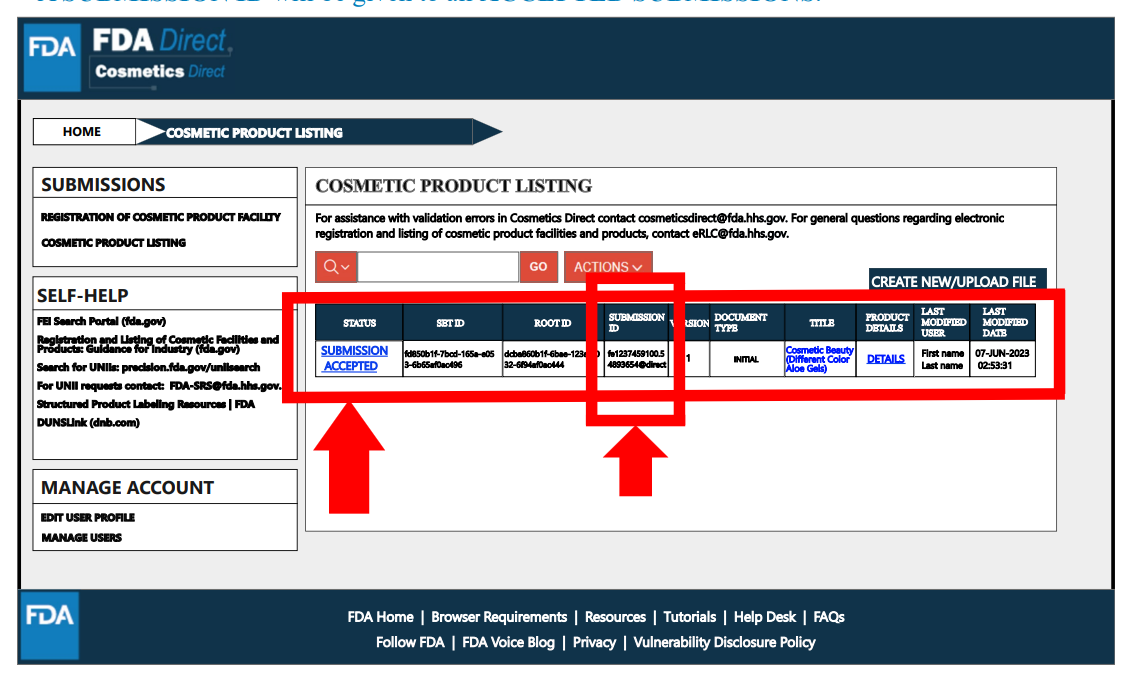
完成注册流程后,状态将变为“提交已接受”,并会获得工厂注册号码。
产品清单登记:
与工厂注册一样,只需在“SUBMISSIONS”处选择产品清单登记即可,随后也会出现选择在平台上创建电子表格或上传SPL文件页面。
Document Type Details处,Document Type是指产品清单登记类型;Set ID、Root ID以及生效日期与设施注册中的解释一致。
Cosmetic Products处,红色框中标星号的是必填项,主要包括责任人相关信息。
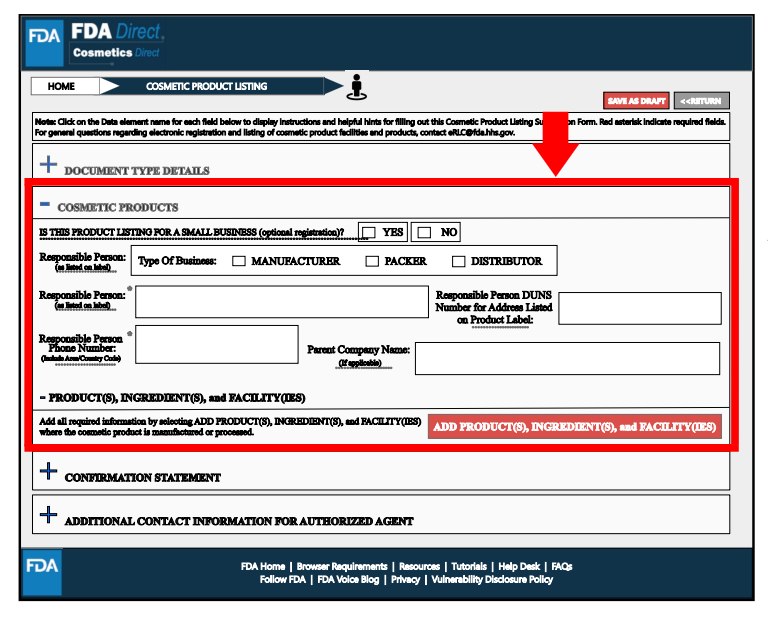
Products, Ingredients, and Facilities处,提供生产或加工的化妆品产品名称、成分、标签、生产企业等信息。
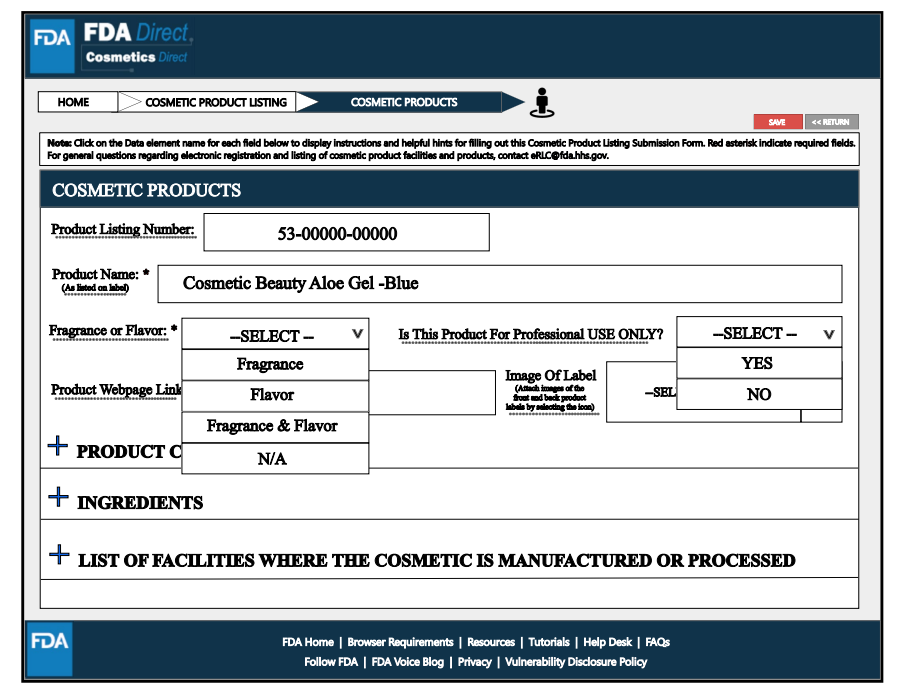
其中,在Product Category Code(s)处,要填写所有必填信息。选择适用于提交的所有产品的类别代码。
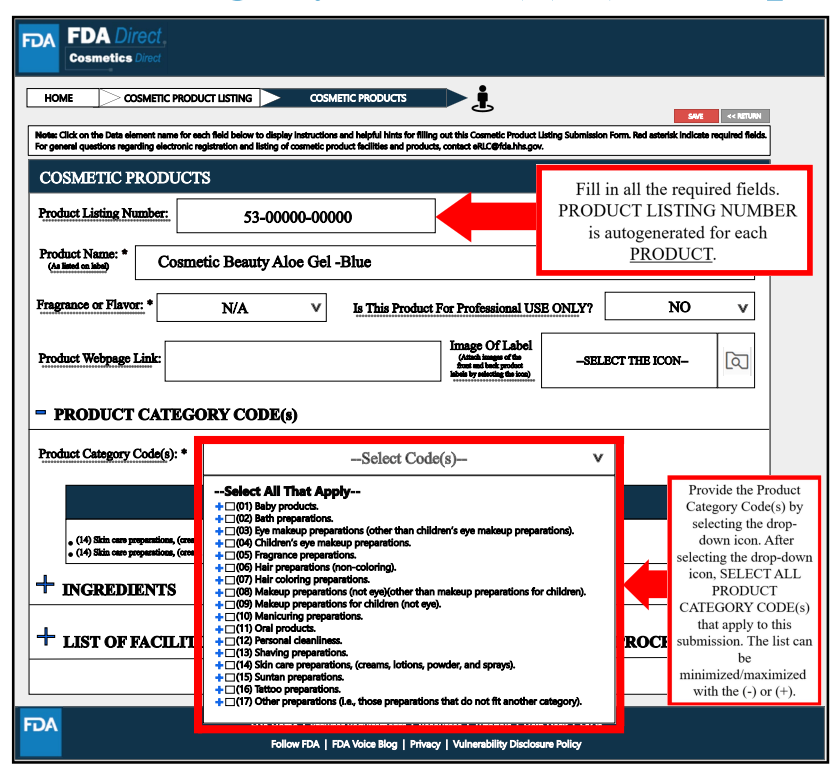
INGREDIENTS处,需要填写清单中产品的所有成分信息,包括原料的名称(按照美国的原料命名规则,可参考CIRS解读“美国对化妆品用原料的管理”)以及UNII编号,但不需要填写配方中原料使用的浓度信息。原料信息可通过文件上传,但暂未说明文件格式要求。

List of Facility处,需要填写生产或加工化妆品产品的工厂信息,此处也需要填写FEI号,其要求与设施注册中的一致。

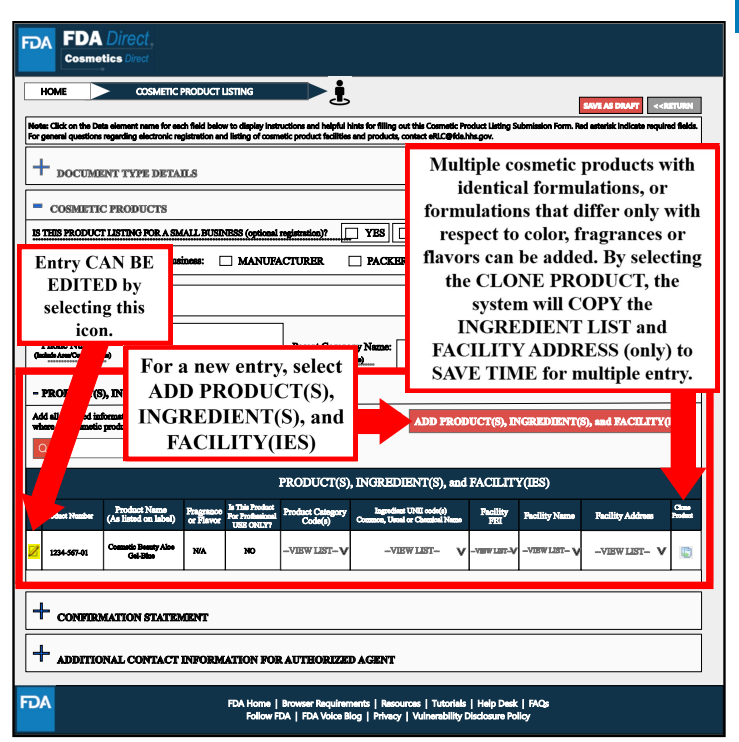
以上信息填写完成后,选择“保存”并弹出以下页面。产品、成分以及工厂信息会展示在下方表格中,且表格最后出现的“CLONE”是对系列产品的工作简化:具有相同配方或仅在颜色或香味上有所不同的多个化妆品产品,通过选择该按键,系统将复制成分清单和设施地址。
Confirmation Statement处,了解确认声明后,选择“同意”;随后进行签字确认。
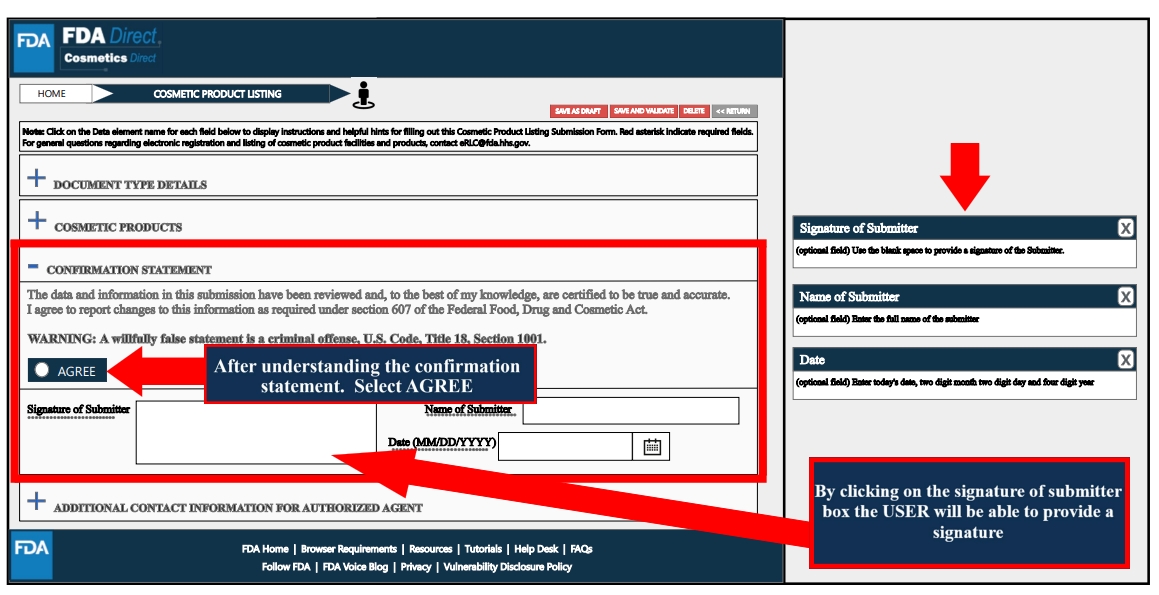
可在dditional Contact Information for Authorized Agent处,填写附加联系人姓名的相关信息(如有)。
在填写所有必要信息后,选择“保存和验证”以识别任何错误,或是选择“提交SPL”以将表单提交给FDA。
在完成产品清单登记流程后,状态将变为“提交已接受”,并分配一个产品清单登记的ID。
二. 纸质提交形式
- 5066为工厂注册登记表,以下为表格的部分信息:

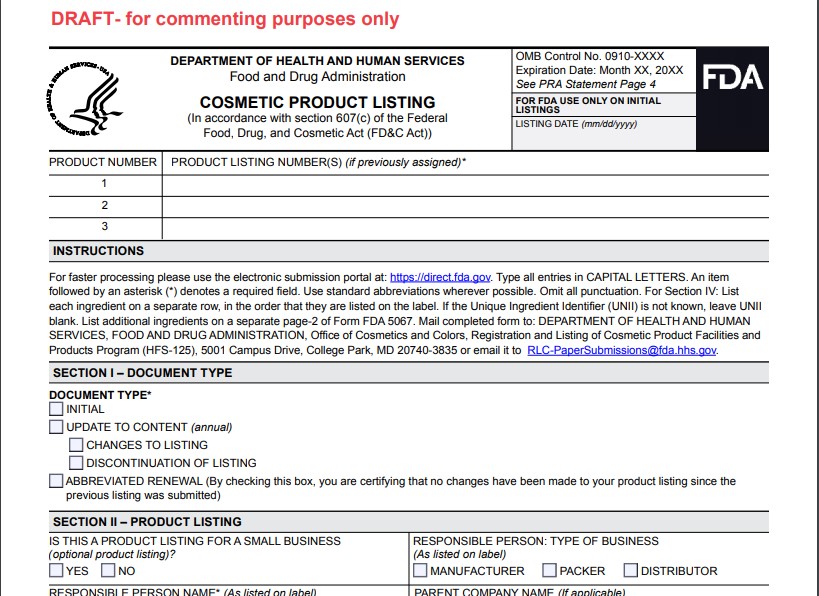
- 5067为产品清单登记表,以下为表格的部分信息:
背景补充
2022年发布的《化妆品监管现代化法案》(MoCRA)对1938年颁布的《联邦食品、药品和化妆品法案》进行重大修订。MoCRA赋予FDA新的权力,扩大FDA对化妆品的监管范围,包括设施注册、产品清单登记以及小企业豁免。
2023年8月7日,FDA根据MoCRA的要求发布了《化妆品设施注册及产品清单登记指南》草案,以上信息均属于该草案,此外也对设施注册及产品清单所需材料、电子提交平台做了具体介绍,详情见瑞旭解读“美国《化妆品设施注册及产品清单登记指南》草案已发布,输美产品该如何合规?”。
- 设施注册:生产或加工化妆品的企业必须向FDA注册其设施,并且每两年更新注册。若FDA有合理理由确定企业在美国分销的化妆品可能导致严重的不良健康后果或导致死亡,并且有合理理由认为该设施制造或加工的其他产品可能受到类似的影响,无法对一个或多个产品分割,或者后果的普遍性足以引发对该设施制造的其他产品的担忧,FDA有权暂停设施注册;如果设施注册被暂停,该工厂的化妆品将禁止在美国分销或销售(或以其他方式引入或交付市场)。
- 产品清单登记:责任人必须向FDA登记每种上市的化妆品,包括产品成分,并且每年进行相关更新。上述的责任人是指名称出现在化妆品标签上的制造商、包装商或分销商。
- 小企业豁免:小企业是指过去3年在美国销售化妆品的平均年度总销售额低于100万美元(根据通货膨胀进行调整)的责任人、设施的所有者和经营者。MoCRA对某些小型企业免除了设施注册和产品清单要求,但这些豁免不适用于从事以下制造或加工的企业:在习惯或通常使用条件下,可能经常接触眼睛粘膜的化妆品;注射用化妆品;内用化妆品;在习惯或通常使用条件下,旨在改变外观超过24小时化妆品(消费者对其的去除不属习惯或通常的使用条件的一部分)。
