婴幼儿配方乳粉中恰当的益生菌添加,对于培育婴儿健康的肠道微生态具有积极作用。它不仅有助于构筑稳固的益菌群,还能够有效抑制致病菌的增长,进而使婴儿的肠道菌群结构更趋向于母乳喂养下的理想状态。
添加益生菌种的配方在进行婴幼儿配方乳粉注册时,需满足哪些要求呢?为帮助企业全面了解,瑞旭集团结合婴配法规及问答要求进行相关分析。
一、婴配奶粉可用菌种的要求是什么?
如果生产企业在婴幼儿配方食品中添加菌种,产品中的活菌数应≥106 CFU/g(mL)。同时,菌种(菌株号)应符合原卫生部、原国家卫生计生委、国家卫生健康委发布的允许用于婴幼儿食品的菌种名单,详见下表1:
表1:可用于婴幼儿食品的菌种名单
菌种名称 | 拉丁学名 | 菌株号 |
嗜酸乳杆菌* | Lactobacillus acidophilus | NCFM |
动物双歧杆菌乳亚种 | Bifidobacterium animalis subsp. lactis | Bb-12 |
HN019 | ||
Bi-07 | ||
鼠李糖乳酪杆菌 | Lacticaseibacillus rhamnosus | GG |
鼠李糖乳酪杆菌 | Lacticaseibacillus rhamnosus | HN001 |
罗伊氏粘液乳杆菌 | Limosilactobacillus reuteri | DSM17938 |
发酵粘液乳杆菌 | Limosilactobacillus fermentum | CECT5716 |
短双歧杆菌 | Bifidobacterium breve | M-16V |
瑞士乳杆菌 | Lactobacillus helveticus | R0052 |
长双岐杆菌婴儿亚种 | Bifidobacterium longum.subsp. infantis | R0033 |
两歧双歧杆菌 | Bifidobacterium bifidum | R0071 |
鼠李糖乳酪杆菌 | Lacticaseibacillus rhamnosus | MP108 |
长双歧杆菌长亚种 BB536 | Bifidobacterium longum subsp. longum BB536 | BB536 |
*仅限用于1岁以上幼儿的食品。
活性菌在研发过程中的试验要求
1. 均匀性工艺验证
样品均匀性分析指标至少包括必需成分中的宏量营养素、维生素、矿物质,可选择成分及其他不易混匀的成分。每类指标中应选择添加量较小的、不易混匀的成分(如活性菌、乳铁蛋白)。
2. 产品稳定性研究
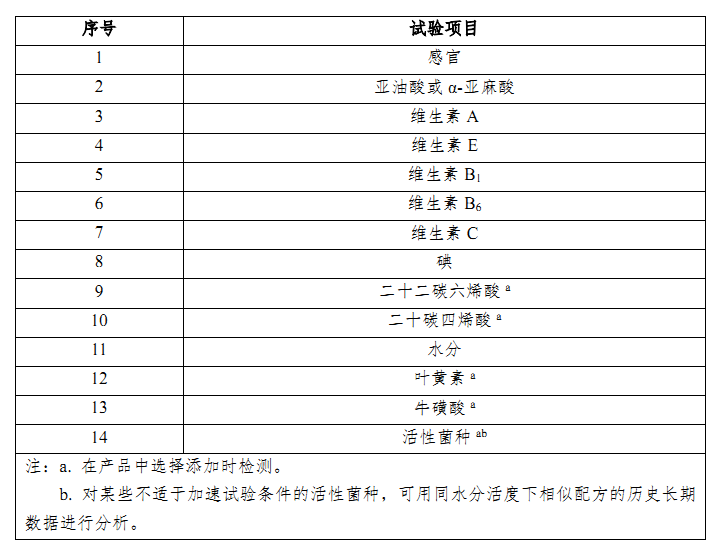
根据《婴幼儿配方乳粉产品稳定性研究指南(试行)》,应选取在产品保质期内易于变化、可能影响产品质量、安全性、营养充足性的项目作为重点试验项目,重点试验项目至少包括附录(详见下表2)中的项目。
活性菌一般在配方组成中用量较小,婴配奶粉产品稳定性分析指标应包含活性菌种。而对于某些不适于加速试验条件的活性菌种,可用同水分活度下相似配方的历史长期数据进行分析。可以理解为,如果按新国标调整前后的配方添加的活性菌相同,且水分活度无明显差异时,可以使用调整前同一申请人已获注册配方的历史长期数据进行分析。
表2:稳定性重点试验项目
三、注册前应注意哪些要点:
1. 新国标注册类型
已获注册的产品配方增加或去除可选择成分的,按注销原配方申请新配方注册办理。其中,涉及膳食纤维(包括低聚果糖、低聚半乳糖、多聚果糖、棉子糖、聚葡萄糖、酵母β-葡聚糖等)、核苷酸以及可用于婴幼儿食品的菌种等三类原料的,仅当添加或去除某一类原料时(不包括同一类别内原料品种调整),按注销原配方申请新配方注册办理。
2. 配方明显差异性
明显差异是指营养特征而非营养成分品种,产品配方及其差异性的基础应为母乳研究、营养学研究成果。当同一申请人在相同年龄段配方之间添加的活性菌品种和(或)量不同时,不构成明显差异。可以理解为,两配方之间仅一方添加益生菌这一类原料才属于明显差异。
四、新国标申报应提供哪些相关资料?
1. 提供菌株原料的来源说明;
2. 提供菌株鉴定报告,报告应满足以下要求:
- 鉴定报告可由申请人或供应商提供;
- 鉴定报告应鉴定到株水平;
- 菌株鉴定应在申请日前两年内完成。
3. 提供因使用菌株可能引起产品杂菌污染的防控措施,应至少包含以下内容:
- 活性菌原料的质量规格和检测报告:提供活性菌原料的质量规格、卫生学指标及相应的检测报告,包括但不限于菌株组成、计数、化学及微生物污染等指标;
- 活性菌原料管理:对供应商选择、进货查验程序(包括但不限于各种质量规格及卫生学指标)、原料储运条件、出入库管理等有明确要求;
- 成品生产相关过程控制:保证生产过程中的菌株一致性,提供使用活性菌原料的关键工序及清场等环节的控制措施;
- 成品中相关项目检测等措施:对成品中的活性菌计数及微生物污染指标进行批批检测。如使用的是厌氧的活性菌(如双歧杆菌),产品检验报告中应包括菌落总数的项目。
4. 申请材料简化:
同一申请人不同配方的申请材料中,各配方使用的菌株相同、原料组成相同且供应商相同的,按新国标申请注册时,菌株溯源、杂菌污染防控等相关材料可以简化。也就是说,可在某一配方的申请材料中提供完整内容,其他配方中提供一致性说明即可。
若您对婴配奶粉境内外生产企业新国标注册有任何疑问或需要任何帮助,欢迎致电联系瑞旭集团食品事业部:0571-87206538。
了解更多婴配相关知识,可关注公众号【CIRS 食品合规互动】。

