一. 毒理实验的定义及内容
毒理学实验是指给实验动物进行不同途径、不同期限的染毒、检测各种毒性终点的实验。其目的是确定无害作用水平、毒性类型、靶器官、剂量-反应关系,为安全性评价或危险性评价提供重要的资料。
GB 15193.1-2014规定了食品安全性毒理学评价的程序。根据该标准,食品安全性毒理学评价试验的内容包括:急性经口毒性试验,遗传毒性试验,28天急性经口毒性试验,90天急性经口毒性试验,致畸试验,生殖毒性试验和生殖发育毒性试验,毒物动力学试验,慢性毒性试验,致癌试验,慢性毒性和致癌试验合并试验。
二. 申报前需要进行毒理实验的食品种类
功能性保健食品(需注册的类别),新食品原料,食品添加剂新品种,食品接触材料添加剂和树脂新品种。
三. 功能性保健食品(需注册)的毒理实验要求
由于《保健食品检验与评价技术规范(2003版)》已被废止,本文关于保健食品毒理实验的内容均来自于《保健食品毒理学评价程序(征求意见稿)》。
3.1保健食品的毒理试验
- 受试物要求
样品包装 | 包装完整的定型产品 注:由于推荐量较大等原因不适合以定型产品进行试验时,可对送检样品适当处理(如浓缩,部分去除辅料)。需提供处理说明及相应证明文件。 |
样品批次 | 与保健食品功能学试验所用样品批号一致,并且为卫生学试验所用三批样品之一(益生菌、奶制品等产品保质期短于整个试验周期的产品除外)。 |
- 毒理试验项目
- 一般应进行急性经口毒性试验、三项遗传毒性试验和28天经口毒性试验,根据实验结果和目标人群确认是否需要进行其他试验项目。
- 若保健食品为非传统工艺生产且导致物质基础发生重大改变,应进行急性经口毒性试验、三项遗传毒性试验、90天经口毒性试验和致畸试验,必要时开展其他毒性试验。
- 以普通食品、保健食品原料目录内的物质为原料,仅采用物理粉碎或水提等传统食品生产工艺生产、食用方法与传统食用方法相同,且原料推荐食用量为常规用量或符合国家相关食品用量规定的保健食品,一般可不开展毒性试验。
注:关于急性经口毒性试验、三项遗传毒性试验和28天经口毒性试验的解读,请点击“大比对:保健食品03版《检验与评价技术规范》VS《毒理学评价程序》”了解详情。
3.2 保健食品新原料
当在注册类保健食品中使用保健食品新原料时,除对产品的安全性评价外,还需对该新原料进行安全性评估。根据目前规定,保健食品新原料的安全性评估应参照新食品原料安全性审查的有关规定进行(新食品原料的毒理学试验部分详见下)。
四. 新食品原料的毒理实验要求
- 新食品原料是指在我国无传统食用习惯的以下物品:
- 动物、植物和微生物;
- 从动物、植物和微生物中分离的成分;
- 原有结构发生改变的食品成分;
- 其他新研制的食品原料;
- 新食品原料的毒理实验项目
毒理学评价是新食品原料安全性评价中的重要内容,试验项目主要由该原料在国内外有无传统食用习惯情况和新食品原料的分类决定。
根据《新食品原料申报与受理规定》,原则上需要开展的毒理学试验如下:
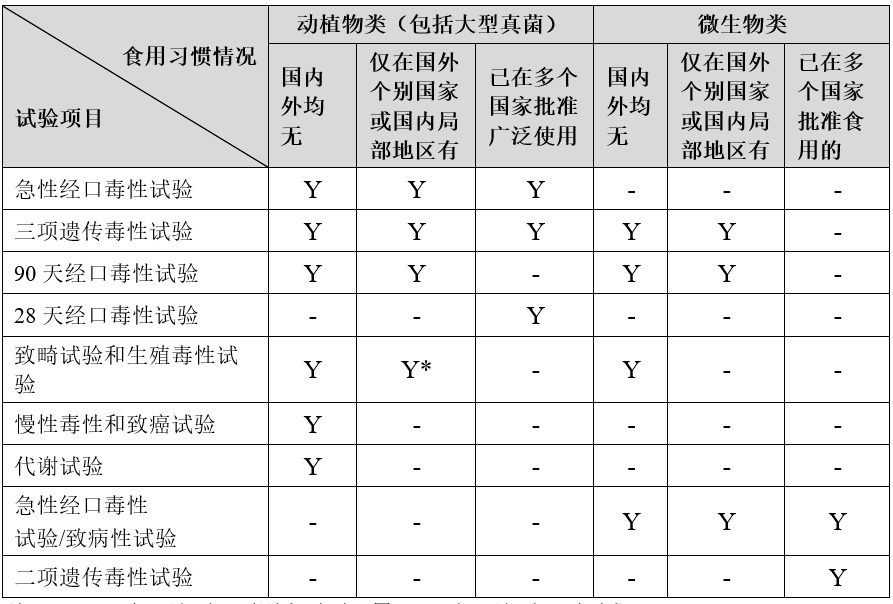
注:1)“Y”表示该项目原则上需要开展;“-”表示该项目不要求
2)*生殖毒性试验一般不需要开展。
五. 食品添加剂新品种的毒理实验要求
食品添加剂新品种的毒理试验需要根据GB 15193.1-2014 食品安全性毒理学评价程序中的选择原则开展。不同类型的食品添加剂新品种在毒理实验项目上的要求不同:
- 香料
S.N. | 情况 | 毒理实验要求 |
1 | 经WHO, FEMA,COE, IOFI中两个或以上批准 | 一般不需要进行毒理实验 |
2 | 仅一个国际组织批准 | 先进行急性经口毒性试验、一项遗传毒性试验 |
3 | 未经国际组织允许使用 | 先进行急性经口毒性试验、三项遗传毒性试验、28天经口毒性试验 |
4 | 动植物可食部分提取的高单一纯度天然香料,其化学结构及相关资料未提示有不安全的 | 一般不需要进行毒理实验 |
- 酶制剂
S.N. | 情况 | 毒理试验要求 |
1 | 长期具有安全食用历史的动植物可食部分生产的酶制剂,且WHO已公布(或不需规定)日容许摄入量或被多个国家或组织批准 | 一般不要求进行毒理实验 |
2 | 其他来源酶制剂,毒理资料完整,且WHO已公布(或不需规定)日容许摄入量或被多个国家或组织批准 |
|
3 | 其他来源酶制剂,一个国家批准使用,WHO未公布日容许摄入量或资料不完整 | 先进行急性经口毒性试验、三项遗传毒性试验、28天经口毒性试验 |
4 | 其他来源酶制剂,无国家批准使用 | 先进行急性经口毒性试验、三项遗传毒性试验、90天经口毒性试验和致畸试验 |
- 其他食品添加剂(如乳化剂,着色剂,抗氧化剂等)
S.N. | 情况 | 毒理试验要求 |
1 | 毒理学实验完整, WHO已公布允许摄入量或被多个国家或组织批准的 |
|
2 | 只有一个国家批准,WHO未公布过允许摄入量或资料不完整 | 先进性急性经口毒性试验,三项遗传毒性试验,28天经口毒性试验和致畸试验 |
3 | 若为动植物或微生物制取的单一组分、高纯度添加剂,有一个国际组织或国家批准 | 急性经口毒性试验、三项遗传毒性试验,28天经口毒性试验 |
4 | 若为动植物或微生物制取的单一组分、高纯度添加剂,无国际组织或国家批准 | 先进性急性经口毒性试验,三项遗传毒性试验,90天经口毒性试验和致畸试验 |
六. 食品接触材料新物质(添加剂、树脂)的毒理实验要求
根据《食品相关产品新品种申报与受理规定》,食品接触材料新物质的毒理实验需依据产品的迁移量实验结果确定。物质迁移量越低,需要提供的毒理学试验报告越简单。
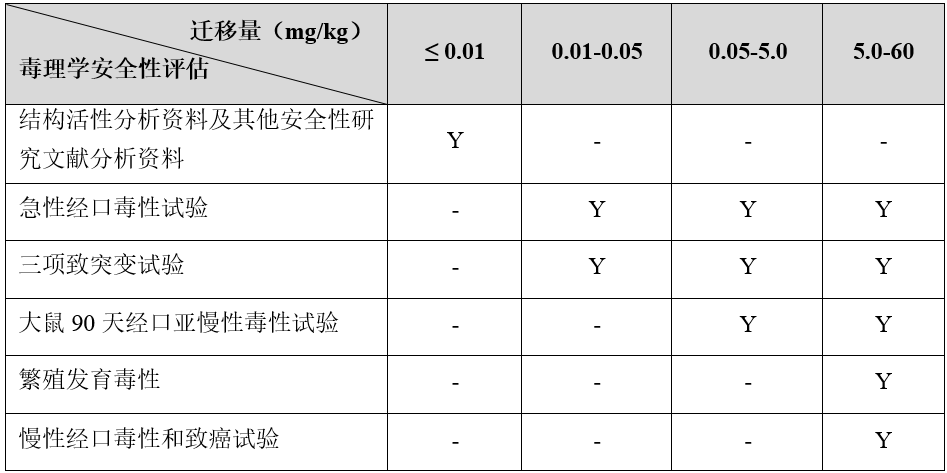
注. 1. “Y”表示该项目原则上需要开展;“-”表示该项目不要求;
2. 高分子聚合物(平均分子量大于1000道尔顿)应当提供各单体的毒理学安全性评估资料;
七. 毒理学报告出具实验室要求
产品类别 | 实验室要求 | 试验方法 | |
1 | 功能性保健食品(需注册的) | 国内有食品检验资质并在SAMR备案过的实验室 | 《保健食品毒理学评价程序》(正式版本还未发布) |
2 | 新食品原料 |
| GB 15193系列毒理实验标准。若在国外GLP实验室进行,试验方法未规定。 |
3 | 食品添加剂新品种 | ||
4 | 食品接触材料添加剂和树脂新品种 |
结语
食品安全毒理学试验是评价食品及食品原料安全性的重要手段。通常情况下,一个新产品或一个新物质的毒理试验需要花费数月甚至一年以上的时间,费用从几万到几十万不等。因此,了解不同物质申报时的毒理试验要求,选择合理的毒理试验项目对于节约申报时间和成本有着重要作用。在开展相关新产品和新物质的申报前,申请人应当对此进行充分评估。
我们的服务:
