根据国家市场监管总局2021年2月1日发布的《辅酶Q10等五种保健食品原料备案产品剂型及技术要求》配套解读可知:辅酶Q10、褪黑素、螺旋藻、破壁灵芝孢子粉、鱼油五种原料制成的单方产品的备案仅针对国产保健食品,不包括首次进口的保健食品。目前,首次进口的这5类产品仍然需要按照《保健食品注册与备案管理办法》要求,向国家市场监管总局申请注册。
瑞旭集团推断,在《食品安全法》修订并实施前,进口辅酶Q10等产品仍旧需要执行注册管理制度。因此,在本篇文章中,瑞旭集团整理对比了进口保健食品注册与备案的主要区别,帮助进口企业深入了解在中国市场准入过程中的优劣势。
1. 进口保健食品注册与备案的申报范围
目前,根据《食品安全法》以及《保健食品注册与备案管理办法》的相关规定,首次进口的保健食品注册与备案的申报范围分别为:
n 备案:首次进口的属于补充维生素、矿物质等营养物质的保健食品(即:营养素补充剂需申请备案)。
n 注册:除营养素补充剂外,其他首次进口的保健食品需要申请注册(即:功能性保健食品需申请注册)。
2. 注册与备案的试验要求区别
毫无疑问的,申请注册要比备案多做更多的试验。两者需要开展的试验如下表所示:
注册试验项目 | l 3批次产品技术要求全项目检验; l 3批次产品的功效成分或标志性成分、卫生学、稳定性试验; l 1批次毒理学试验; l 1批次动物功能试验和(或)人体试食试验; l 功效成分或标志性成分方法学验证; l 其他需要的试验,例如采用了特殊的原料。 |
备案试验项目 | l 3批次产品技术要求全项目检验; l 3批次产品的功效成分或标志性成分、卫生学、稳定性检验; l 原料的全项目检验报告(仅限辅酶Q10等5个功能性原料); l 功效成分或标志性成分方法学验证(若有需要)。 |
对比可知,注册需要额外开展的试验主要在于:毒理学试验、动物功能试验和(或)人体试食试验。不同的保健功能需要开展的功能评价试验均不同,而对于辅酶Q10等5个原料制成的单方产品而言,与国产备案相比,进口产品申请注册需要额外进行的试验主要包括:
Ø 辅酶Q10(增强免疫力):毒理学试验,动物功能试验
Ø 辅酶Q10(抗氧化):毒理学试验,动物功能试验,人体试食试验
Ø 鱼油(辅助降血脂):毒理学试验,动物功能试验,人体试食试验
Ø 褪黑素(改善睡眠):毒理学试验,动物功能试验
Ø 破壁灵芝孢子粉(增强免疫力):毒理学试验,动物功能试验
Ø 螺旋藻(增强免疫力):毒理学试验,动物功能试验
3. 卷宗要求区别
除提交的试验报告不同外,保健食品注册与备案在卷宗要求中最主要的区别在于:注册需要提交完整的产品研发报告。而对备案产品而言,由于从原料到产品的要求都是规范化、标准化的,因此,无需提交产品研发报告。
对于辅酶Q10等5个单一原料制成的进口产品,在注册申报过程中,应按要求提交产品研发报告。但由于辅酶Q10等5种原料在我国本有长久食用历史,且配方研究成熟,最重要的是已在保健食品原料目录中,因此《辅酶Q10等五种保健食品原料目录》和《辅酶Q10等五种保健食品原料备案产品剂型及技术要求》可以作为产品研发报告的最主要的一个依据。对比其他进口功能性保健食品,辅酶Q10等5种原料制成的单一配方的进口保健食品,在研发报告的撰写上要容易许多,企业无需担心这点。
项目 | 注册 | 备案 |
卷宗要求区别 | l 需提供完整的产品研发报告,包括: 1) 安全性论证报告; 2) 保健功能论证报告; 3) 生产工艺研究报告; 4) 产品技术要求研究; | l 无研发报告要求; |
4. 申报流程区别
n 进口保健食品注册申报流程简图
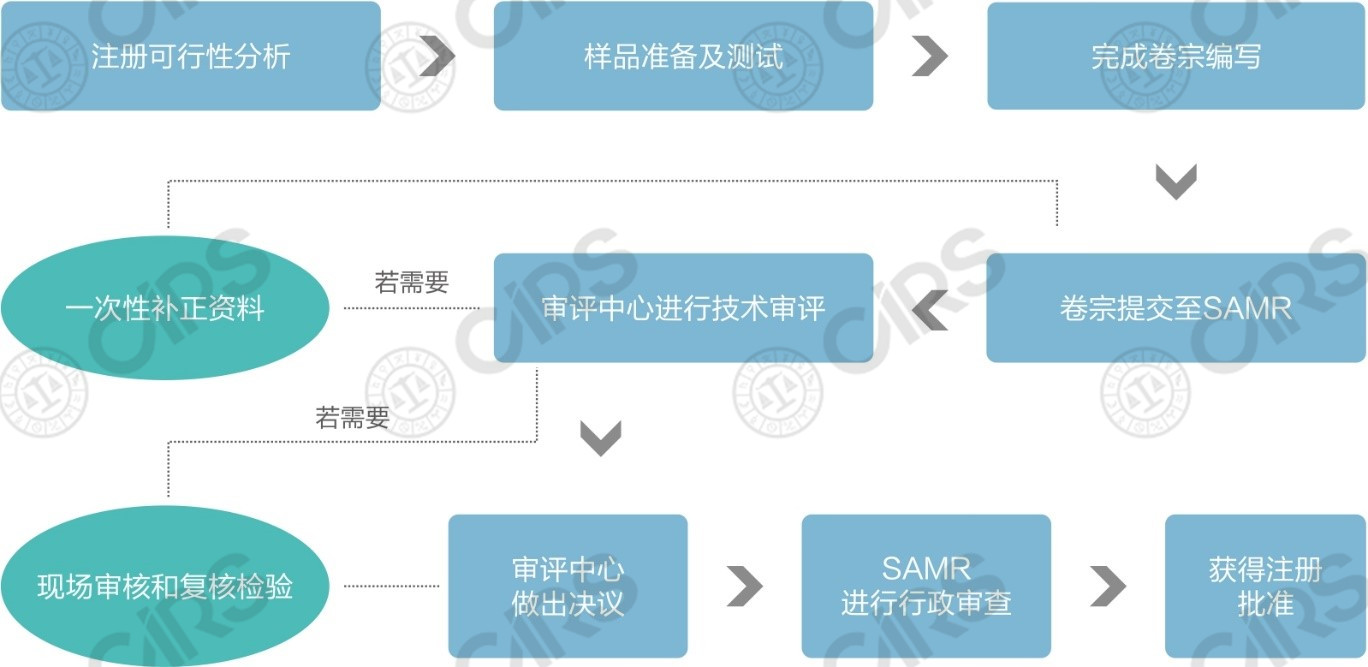
n 进口保健食品备案申报流程简图
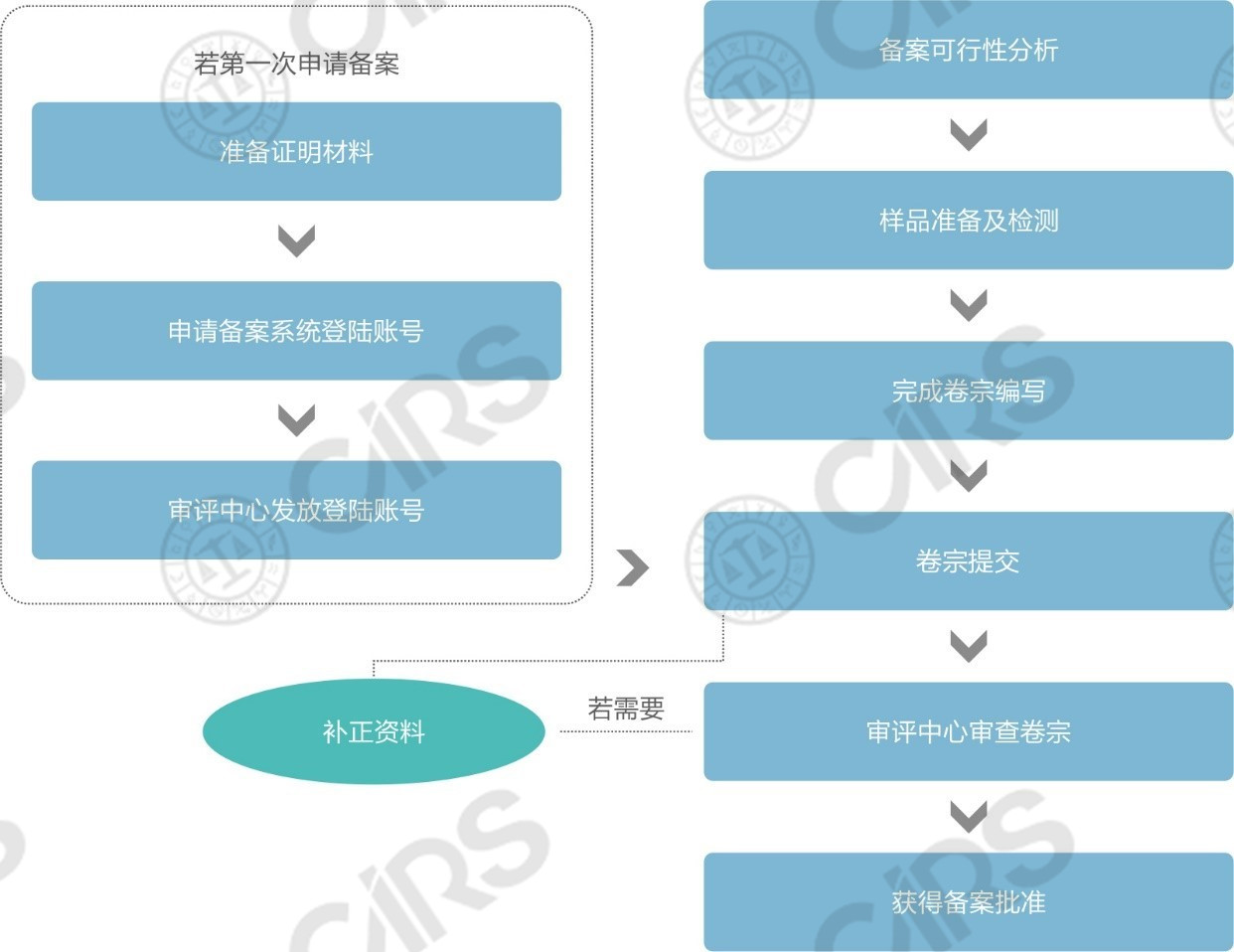
比对上述两个流程图,进口保健食品注册与备案在申报流程上的区别主要包括以下四方面:
流程区别 | 注册 | 备案 |
系统账号申请 | 填写信息后即刻获得注册系统账号,无需经过人工审核 | 进口产品在首次备案前应准备好“申请人资质证明材料、联系人授权书、法人护照”三份文件向食品审评中心申请备案系统账号,食品审评中心人工审核通过后向企业发放账号 |
专家技术审评 | 需经过专家技术审评,审评组包括: l 安全性专家审查组 l 保健功能专家审查组 l 工艺专家审查组 l 产品技术要求专家审查组 | 无需专家技术审评,备案材料由食品审评中心工作人员进行审查 |
现场核查与复核检验 | 视技术审评情况,可能需要开展 | 无需 |
国家市场监督管理总局(SAMR)的行政审批 | 需要,产品经国家市场监督管理总局行政审批,做出批准决定后方能获得注册 | 无需 |
5. 周期对比
基于上述的试验要求、卷宗要求、申报流程等方面的区别,进口保健食品注册与备案在整个申报周期上的对比如下:
主要流程 | 预估周期(进口注册) | 预估周期(进口备案) |
申报可行性分析 | 7个工作日 | 3个工作日 |
申请人样品准备 | 视申请人准备情况 | 视申请人准备情况 |
试验检测 | 8-16个月 (主要视产品功能而定) | 4个月 |
卷宗编写与提交 | 2个月 | 1个月内 |
受理机构受理 | 5个工作日内 | / (线上提交即可) |
注册技术审评, 或食品审评中心的备案审查 | 60个工作日内 | 一般1-2个月 |
补正材料(若有需要) | 3个月内 | 视补正要求而定 (一般1个月内) |
再次注册技术审评/备案审查 | 60个工作日内 | 一般1-2个月 |
现场核查和复核检验(若有需要) | 进口产品视情况而定 (国产:90个工作日) | / |
审评中心报送结果至SAMR | 5个工作日内 | / |
SAMR行政审查,做出审批决定 | 20个工作日内 | / |
将审批材料移交受理机构 | 3个工作日内 | / |
受理机构向申请人发出批准证书 | 10个工作日内 | 备案系统直接发出证书 |
合计 | 15+个月 | 8-10个月 |
如前文所述,注册产品需要额外开展包括毒理学试验、功能性评价等试验,因此整体申报周期比备案长。
而对于辅酶Q10、褪黑素、破壁灵芝孢子粉、鱼油、螺旋藻这5个原料制成的单方产品而言,由于配方简单且成熟、安全性有充分的论证,在卷宗编写、专家技术审评、补正材料等阶段会比其他的注册类产品会更为顺利,节约更多的时间,预计15个月或可拿下进口注册证书。
进口备案方面,除申请人准备的卷宗质量优劣外,以下两方面也会对整体备案周期产生影响。其一:首次申报的企业需获取备案系统登录账号。申请人向食品审评中心提交申请后一般需等待1个月左右出结果。而进口保健食品备案系统账号的申请是存在一定难度的,若申请人不了解相关要求,极容易被多次退回,甚至花费1年以上的时间来获取账号。因此,申请人应尽早申请,勿等到产品的备案试验都已完成还未获取账号,空等一段时间来申请账号。其二:进口产品提交备案申请后需由食品审评中心进行材料审查。该阶段的审查周期法规中并无具体的规定,因此会存在一定的浮动范围,目前审评中心的反馈周期一般在1-2个月。
6. 结语
综上所述,进口保健食品注册与备案在“申报范围”、“试验要求”、“卷宗要求”、“申报流程”等方面均有不同规定,因而导致这两种准入方式在申报周期以及企业花费的成本上均存在差异。毫无疑问的是,保健食品注册比备案的周期更长,费用更高。但辅酶Q10等五个单一原料制成的进口保健食品在注册时又存在一定的特殊性。
目前,辅酶Q10等五个单一原料制成的国产产品已经纳入备案范围,进口的仍需要申请注册。但根据上述文章的分析,注册时研发报告的准备不再是难点,周期上多出的半年时间也能被大部分企业接受。除此之外,在系统账号的申请上,注册账号是系统申请立即拿到,备案账号倒有可能需要补正多次方可拿到。 虽然辅酶Q10等产品的注册花费的成本和周期相比备案有所增加,但有实际需求的进口企业或许也不必对注册望而却步,在《食品安全法》修订前,可及时布局抢占进口产品的市场。
我们的服务:
