背景
2020年12月1日,国家市场监督管理总局会同国家卫生健康委员会、国家中医药管理局制定并发布了辅酶Q10等五种保健食品原料目录(以下简称《原料目录》)。自此,以2020年12月1日为时间节点,对于使用辅酶Q10等五种原料的保健食品:在《原料目录》发布后(即2020年12月1日之后)提出申请的单方国产产品应申请保健食品备案,进口产品仍需申请保健食品注册;而对于在《原料目录》发布前(即2020年12月1日之前)受理的国产和进口注册申请,以及已获得注册的保健食品,需要进行注册转备案申请。
为什么要选择申请注册产品转备案,而不是以新产品的身份直接申请备案?
国产保健食品:注册转备案不是唯一选择,但存在利好政策
作为国产保健食品,以辅酶Q10等五种原料的单方新产品可以直接申请备案。因此,国产的此类产品,既可以放弃注册产品的身份,完全作为新产品去申报保健食品备案,也可以选择申请注册转备案。
选择注册转备案的优点在于部分转备案产品不需要重新进行产品功效成分、卫生学、稳定性试验(该利好政策同样适用于转备案的进口保健食品),大大缩短了申报周期。
- 已获得注册证书的保健食品申请转为备案时,原辅料或用量及技术要求如果没有发生改变的,产品的检验报告只需要提交全项目检验报告,而不需要提交产品功效成分、卫生学、稳定性检验报告;
- 《原料目录》发布前已受理注册申请的保健食品申请转为备案时,原辅料或用量及技术要求如果没有发生改变的,产品功效成分、卫生学、稳定性检验报告可以直接使用注册申报时提交的检验报告,同时提供全项目检验报告。
进口保健食品:注册转备案是唯一选择
- 以辅酶Q10等五种原料的单方新产品备案仅针对国产保健食品,不包括首次进口的保健食品。换言之,以辅酶Q10等五种原料的进口新产品无法申请备案,只能申请注册。
- 对于已经获得注册证书的此类单方产品,无法申请延续注册,而是应该在注册证书有效期前申请注册转备案。
- 对于《原料目录》发布前已经受理注册申请的进口保健食品,使用原料目录以内原料的,也应该申请注册转备案。
申请注册产品转备案包括两大步骤:1)获得原注册人资质;2)申请产品备案。具体内容如下:
获得原注册人资质
在申请注册产品转备案前,应先获得原注册人资质,哪些情况可以申请原注册人资质?
- 已受理的保健食品:《原料目录》发布前受理的以辅酶Q10、鱼油、褪黑素、破壁灵芝孢子粉和螺旋藻为原料的单方产品注册申请(包括新产品注册、延续注册、变更注册和转让技术注册),并且产品符合备案相关技术要求的,可以作为原注册人;
- 已获得注册的保健食品:以辅酶Q10、鱼油、褪黑素、破壁灵芝孢子粉和螺旋藻为原料的单方产品,且符合备案相关技术要求的,可以作为原注册人。
- 《原料目录》发布前受理的保健食品注册申请,以及获得注册的保健食品,其部分原料或用量不符合《原料目录》以及备案技术要求的,注册申请人或证书持有人同意按照《原料目录》调整产品原料和产品技术要求,也可以作为原注册人。
原注册人资质的申请流程
- 已获得注册的产品:

申请流程具体说明:
1) 注册申请人在保健食品注册管理系统中按变更注册要求提出“注册转备案”变更申请;
2) 获得国家市场监督管理总局确认原注册人资质的《审评意见通知书》;
- 《原料目录》发布之前受理的新产品注册、延续注册、变更注册和转让技术注册,申请人可选择以下2种途径获得原注册人资质:
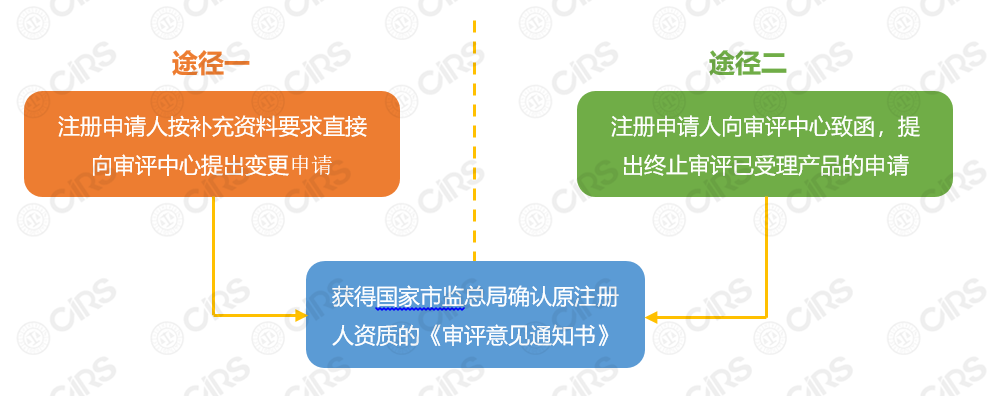
申请流程具体说明:
1) 注册申请人可选择途径一或途径二获得原注册人资质,具体为:
途径一:注册申请人按补充资料要求直接向审评中心提出变更申请;
途径二:注册申请人向审评中心致函,提出终止审评已受理产品的申请。
2) 获得国家市场监督管理总局确认原注册人资质的《审评意见通知书》;
(备注:对于途径一中的“补充资料”,一般是由审评中心向注册申请人发出“补充资料”要求后,申请人按照要求提交补充资料,可在补充资料时提出注册转备案申请。对于符合备案要求的产品,审评中心一般不再要求补充资料,而是直接出具《未获批准通知书》,拿到该通知书时,注册人即获得原注册人资质。采用途径一时,需要等待审评中心出具的意见通知书,申请人的处境较为被动。)
原注册人资质的申请资料要求(已获得注册的产品)
国产保健食品
1) 国产保健食品变更注册申请表及注册申请人对申请材料真实性负责的法律责任承诺书;
2) 注册申请人主体登记证明文件复印件;
3) 保健食品注册证书及其附件的复印件;
4) 变更的注册事项、理由和依据;
5) 注册转备案申请书。
进口保健食品
1) 进口保健食品变更注册申请表及注册申请人对申请材料真实性负责的法律责任承诺书;
2) 注册申请人主体登记证明文件复印件;
3) 保健食品注册证书及其附件的复印件;
4) 产品生产国(地区)政府主管部门或者法律服务机构出具的注册申请人为上市保健食品境外生产厂商的资质证明文件;
5) 产品生产国(地区)政府主管部门或者法律服务机构出具的保健食品上市销售一年以上的证明文件,或者产品境外销售以及人群食用情况的安全性报告;
6) 出口国(地区)对产品实施批准的,应出具出口国(地区)主管部门准许上市销售的证明文件;
7) 产品生产国(地区)或者国际组织与保健食品相关的技术法规或者标准原文;
8) 变更后的产品包装、标签、说明书实样;
9) 由境外注册申请人常驻中国代表机构办理注册事务的,提交《外国企业常驻中国代表机构登记证》及其复印件;境外注册申请人委托境内的代理机构办理注册事务的,提交经过公证的委托书原件以及受委托的代理机构营业执照复印件;
10) 变更的具体事项、理由和依据;
11) 注册转备案申请书。
申请产品备案
- 国产保健食品:以原注册人身份向备案管理部门提出备案管理信息系统登录账号申请(已有登录账号的除外)或产品备案申请。
- 进口保健食品:目前产品备案申请政策不明朗
根据国家市监总局食品审评中心2017年7月5日发布的问答“原注册人产品转备案应按何流程进行?”,获得确认原注册人资质的《审评意见通知书》后,以原注册人身份提出备案账号申请(已有登录账号的除外)和产品备案申请。但是,瑞旭集团发现进口保健食品备案系统中没有关于“功能性保健食品”的申请入口。根据与审评中心专家的沟通,目前政府部门针对进口保健食品(以辅酶Q10等五种原料的产品)获得原注册人资质之后,如何申请产品备案仍在商讨中。
瑞旭将持续关注以辅酶Q10等五种原料的进口保健食品转备案的最新政策变动,对于已获得注册证书的进口产品,原注册人资质申请时需要提供一系列的证明文件,申请人准备这些证明文件的周期一般较长,因此,瑞旭集团建议企业提前准备申请原注册人资质,以确保进口产品转备案政策确定后,能获得率先入场的机会。
我们的服务:
