为了指导企业更好地进行保健食品注册和备案工作,国家市场监督管理总局曾多次在保健食品备案管理信息系统和食品审评中心发布保健食品常见问题与解答。瑞旭集团特对这些内容进行汇总和梳理,形成保健食品常见问题与解答系列,供企业查阅。
往期回顾:保健食品常见问题与解答——注册篇(1):配方及原料。
保健食品常见问题与解答——注册篇(2):功能学和毒理学评价。
本期内容:保健食品常见问题与解答——注册篇(4):技术要求和说明书。
01 保健食品产品技术要求常见问题及注意事项(2021-10-08)
答:产品技术要求是保障保健食品质量可控的重要技术资料,也是保健食品注册证书附件的重要组成部分。《保健食品注册与备案管理办法》规定了保健食品产品技术要求的主要内容,《保健食品注册审评审批工作细则(2016年版)》《保健食品注册申请服务指南(2016年版)》等规范性文件进一步明确了各项内容的具体要求。但是,在审评过程中,我们发现申请人提交的产品技术要求材料质量不高,问题较多,极大地影响了审评工作效率。
为进一步提高申请材料质量,提升工作效率,我们将产品技术要求常见问题和注意事项进行了汇总,供注册申请人借鉴。
一、常见问题及注意事项
(一)注册信息系统填报的产品技术要求与纸版资料不一致。请按照最终确定版本,认真、逐项填写产品技术要求内容。产品技术要求电子版应为文本格式,请勿提交PDF、图片、链接等格式文件。
(二)延续、变更、转让等注册申请,提交的产品技术要求内容与原注册内容不一致。请根据原批准证书及附件、注册申请材料,按照新的规定,完善产品技术要求。
(三)擅自修改产品技术要求未发补内容。补充资料中需提交产品技术要求的,不要擅自修改审评意见未涉及内容,同时产品技术要求电子版与纸版内容保持一致。
(四)其他常见问题,主要包括:
1.【生产工艺】项
(1)除首次申报产品(受理编号为国食健申),其余申报类型产品生产工艺主要流程应与原批件保持一致,同时应当在主要关键工艺后以括号标注关键工艺参数。
(2)提取关键工艺参数应包括溶剂、溶剂量、温度、次数、时间等。例如:分别加6、6、8倍量70%乙醇回流提取3次,每次2h。属混合提取的,简述主要提取过程。
(3)提取后干燥参数应包括方法、温度。例如:喷雾干燥(进风温度160~180℃,出风温度70~80℃)、减压干燥(50℃,-0.08MPa)等。
(4)灭菌应提供原料、方法及参数。例如:辐照灭菌(人参,60Co,5KGy)、湿热灭菌(121℃,30min)等。
(5)发酵参数应包括培养基组成、菌种、温度、时间、pH、终止发酵方法等。
(6)涉及精制工艺的,需要列出精制工艺过程,例如:大孔吸附树脂型号、前处理、吸附方法、洗脱方法等。
2.【直接接触产品包装材料的种类、名称及标准】
(1)应提供与原注册资料、送检样品及检验报告一致的直接接触产品包装材料的种类、名称及标准。
(2)直接接触产品包装材料执行标准为企业标准的,应提供企业标准全文,并以表格形式表示。
3.【感官要求】
(1)状态项应包括杂质描述。
(2)软胶囊应分别对囊皮及内容物的色泽、性状进行描述,硬胶囊无需对囊壳色泽进行描述。
(3)包衣片剂应分别对包衣及片芯的色泽进行描述。
4.【理化指标】
(1)属性名为颗粒的,参照《中华人民共和国药典》中“颗粒剂”的规定制定粒度、溶化性指标,并检测三批产品粒度、溶化性卫生学。属固体饮料的,按照固体饮料国家标准执行并修改属性名。
(2)属性名为含片的,应按《中华人民共和国药典》中“片剂”的规定制定溶化性指标,并检测三批产品溶化性稳定性。属糖果等的,按照糖果国家标准执行并修改属性名。
(3)酒剂应按照国家标准限量要求,制定甲醇、氰化物指标(注明以100%酒精度计)。
5.【微生物指标】
应符合GB 16740-2014《食品安全国家标准保健食品》的规定。原注册申请或批准证书内容与现行国家标准冲突的,应当进行相应调整,使之符合现行国家标准的规定。
6.【标志性成分指标】
(1)注册申请或批准证书内容为“《保健食品检验与评价技术规范》(2003年版)”的,列出检验方法全文,并根据产品具体情况对不明确的方法内容(如样品前处理等)进行细化并提交研究报告。无需细化明确的,提交说明。
(2)引用的国家标准有多个检测方法的,应当明确检测方法为第几法。例如:应明确钙的检测方法为第几法,GB 5009.92中“第二法EDTA滴定法”。
7.【装量或重量差异指标/净含量及允许负偏差指标】
(1)《中华人民共和国药典》“制剂通则”项下有相应要求的产品剂型,装量或重量差异指标应符合相应剂型的规定。例如:应符合《中华人民共和国药典》“制剂通则”项下“胶囊剂”的规定。
(2)普通食品形态产品应检测并制定净含量及允许负偏差指标,应按最小销售包装制订净含量及允许负偏差指标,指标应符合《定量包装商品净含量计量检验规则》(JJF1070)规定。例如:净含量为50g/盒,允许负偏差为9%。
(3)粉剂应制订净含量及允许负偏差指标。属散剂、颗粒剂等的,应按照《中华人民共和国药典》“制剂通则”项下相应要求制订装量或重量差异指标,并相应修改产品属性名。
8.【原辅料质量要求】
(1)原辅料名称应与【原料】【辅料】项保持一致。
(2)原辅料符合国家相关标准的,应提供正确的现行有效版本的标准号及标准名称。
(3)无国家相关标准的,应参考《保健食品注册申请服务指南》5.2.2.4(5)制定原辅料质量要求,包括原料名称(动植物类包括拉丁学名)、制法(包括主要生产工序、关键工艺参数等)、组成、提取率(得率)、感官要求、一般质量控制指标、污染物、农药残留量、功效成分或标志性成分、微生物等。
(4)提取物质量要求应按《保健食品注册申请服务指南》11.2.1制定,包括原料来源(动植物类包括拉丁名称)、制法(提取溶剂、溶剂量、温度、时间、次数;干燥方法、温度;灭菌方法、参数等)、提取率(范围)、感官要求、一般质量控制指标、污染物指标、农药残留量、标志性成分指标、微生物指标等。
(5)银杏叶提取物质量要求应包括原料来源(包括拉丁名称)、制法、性状、水分、灰分、得率、铅、总砷、总汞、加工助剂残留(根据制法,如大孔吸附树脂、乙酸乙酯残留等)、微生物(包括菌落总数、大肠菌群、霉菌和酵母、金黄色葡萄球菌、沙门氏菌)、总银杏酸(≤10mg/kg)、总黄酮醇苷(以范围值标示)、萜类内酯(以范围值标示)、游离槲皮素(≤10mg/g)、游离山柰素(≤10mg/g)、游离异鼠李素(≤4mg/g)等指标。并按银杏叶提取物原料质量标准及《国家食品药品监督管理总局关于发布银杏叶药品补充检验方法的公告(2015年第66号)》的要求,提供银杏叶提取物原料自检报告。
(6)原辅料质量要求应引用具有专属性的质量标准,而非通用标准或使用标准。若无相关标准,应参考《保健食品注册申请服务指南》5.2.2.4(5)制定。例如:苹果粉不应引用GB/T 29602《固体饮料》,大豆油不应引用GB 2716《植物油》,某食品添加剂不应引用GB 2760《食品添加剂使用标准》,复配原料不应引用GB 26687《食品安全国家标准复配食品添加剂通则(含第1号修改单)》。
(7)明确空心胶囊、淀粉种类。例如:明胶空心胶囊应符合《中华人民共和国药典》的规定,玉米淀粉应符合《中华人民共和国药典》的规定。
(8)对于有国家相关标准和现行规定的原辅料,质量要求应不得低于国家相关标准和现行规定。例如:氯化高铁血红素质量要求应参照《食品安全国家相关标准营养强化剂氯化高铁血红素(征求意见稿)》制定。硫酸软骨素钠质量要求中应明确原料来源,猪软骨来源的应符合《中华人民共和国药典》规定;其他动物软骨来源的,除比旋光度外应符合《中华人民共和国药典》规定。山楂质量要求中应制定展青霉素指标。
02 以银杏叶提取物为原料的产品,应提交的申报资料(2021-10-08)
答:根据总局要求,为进一步强化审评与监管的衔接,从2016年3月1日起评审的以银杏叶提取物为原料的产品,包括新申报、再注册、技术转让和变更产品,除符合现行法规标准外,注册申请人还应按以下要求提供资料:
一、将银杏叶提取物原料质量标准纳入产品技术要求。
银杏叶提取物原料质量标准应包括:来源、制法、提取率、性状、水分、灰分、铅(≤2.0mg/kg)、总砷(≤1.0mg/kg)、总汞(≤0.3mg/kg)、加工助剂残留(根据制法,如大孔吸附树脂、乙酸乙酯残留等)、微生物(包括菌落总数、大肠菌群、霉菌和酵母、金黄色葡萄球菌、沙门氏菌)、总银杏酸(≤10mg/kg)、总黄酮醇苷(以范围值标示)、萜类内酯(以范围值标示)、槲皮素(≤10mg/g)、山柰素(≤10mg/g)、异鼠李素(≤4mg/g)等。
二、按银杏叶提取物原料质量标准及《国家食品药品监督管理总局关于发布银杏叶药品补充检验方法的公告(2015年第66号)》的要求,提供银杏叶提取物原料自检报告。
03 保健食品益生菌类标志性成分检测方法的选择和确认(2021-10-08)
答:为进一步明确保健食品益生菌类标志性成分检测方法的研发和审评要求,我中心组织专题研讨会,对相关审评问题进行了研究。现将有关情况发布如下,供保健食品注册申请时参考。
鉴于现行的益生菌检测方法国家标准和国际标准基本能够满足保健食品益生菌检测需要,且国家标准和国际标准检测方法稳定、复现、适用,目前暂不将益生菌类标志性成分检测方法学研究资料作为强制性要求,但注册申请人选择和确认的检测方法应符合以下国家标准或国际标准:
(一)检测菌种在现行《可用于保健食品益生菌菌种名单》及《可用于食品的菌种名单》内的益生菌产品,检测方法必须采用GB 4789.34或GB 4789.35规定的方法。
(二)检测菌种不在现行《可用于保健食品益生菌菌种名单》及《可用于食品的菌种名单》内,且检测方法无法采用GB 4789.34或GB 4789.35规定方法的产品,可采用AOAC(Association Of Official Analytical Chemists)微生物检验方法体系、USDA(United States Department of Agriculture)微生物检验方法体系、IDF(International Dairy Federation)微生物检验方法体系、FDA Bacteriological Analytical Manual(BAM)及ISO 16140规定的方法。
(三)检测菌种不在现行《可用于保健食品益生菌菌种名单》及《可用于食品的菌种名单》内,且采用自行制定的检测方法的产品,应提供检测方法选择和确定的依据,与上述国际微生物检验方法体系相应方法的三批产品检测结果比对。
04 保健食品含片与颗粒剂溶化性指标检测、标志性成分或功效成分检测方法学研究资料、按新版食品安全国家标准修改指标的产品,应提供的申报资料(2021-10-08)
答:一、含片与颗粒剂的溶化性指标
含片与颗粒剂中溶化性指标、名称一致,但其测定方法与考察目的不同。含片的溶化性按“崩解时限检查法”检查,考察产品在规定时限内不得崩解,验证物质释放方式与剂型设计的相符性;保健食品常见的颗粒剂包括可溶性颗粒与混悬型颗粒,可溶性颗粒溶化性检查方法为:加热水200mL,5分钟内应全部溶化或轻微浑浊,不得有异物或焦屑,主要目的是检查其是否混有不溶性异物等。
鉴于检测目的不同,保健食品技术审评中,含片的溶化性指标作为产品稳定性重点考察指标,颗粒剂的溶化性指标作为产品非稳定性考察指标,混悬型颗粒暂不要求制订溶化性指标。
二、标志性成分或功效成分检测方法学研究资料
根据产品检测方法来源,应提交产品标志性成分或功效成分检测方法学研究资料,明确检测方法建立的研究过程,验证检测方法的准确性、重现性和适用性。还应按《保健食品注册申请服务指南》(以下简称《指南》),提交研究人员、研究时间、研究地点等溯源性资料。属委托研究的,还应提交委托研究合同(协议)等。
(一)引用国家相关标准方法的,考虑方法建立时已进行方法学研究,不要求提供检测方法建立的研究资料,但应参照GB/T 5009.1《食品卫生检验方法 理化部分 总则》,考察检出限、精密度、准确度、线性范围。
(二)检测方法对国家相关标准方法的样品前处理、检测条件等内容进行修订的,重点对方法修订部分进行方法学研究,提供研究资料,并参照GB/T 5009.1《食品卫生检验方法 理化部分 总则》,考察方法的检出限、精密度、准确度、线性范围。
(三)申请人自行制订检测方法的,应提供全部的方法学建立研究报告,参照GB/T 5009.1《食品卫生检验方法 理化部分 总则》,考察检出限、精密度、准确度、线性范围,并考察所建立方法的专属性与耐用性。
三、标准执行版本更替
对于因标准执行版本更替,引起的标准名称或标准号变化,应根据检测方法变化情况,提交申请材料。
(一)不涉及方法原理与操作步骤变化的,可不再要求申请人进行相关项目的测定。
(二)不能确定或已确定检测方法发生原理或操作步骤变化的,要求申请人提供三批产品新老方法检测比对结果。
四、执行《食品安全国家标准保健食品》(GB 16740)涉及的指标检测
对于执行GB 16740,涉及产品技术要求调整和检测报告要求,应根据指标调整的不同,提交申请材料。
(一)因执行GB 16740,放宽指标限值或减少微生物指标要求的,考虑到原已对相关指标进行了检测,且符合现行GB16740规定,可不再要求提供相关指标检测报告。
(二)因执行GB 16740,需对指标限值从严要求的,应提供具有法定资质的检验机构出具的三批产品该指标检验报告。
(三)因执行GB 16740,需修订大肠菌群检测方法的,应提供三批产品大肠菌群自检报告。
(四)因执行GB 16740,确需单独提交污染物和微生物指标变更注册申请的,严格按照《关于实施<食品安全国家标准 保健食品>有关问题的公告》(2015年第104号)和《关于实施<食品安全国家标准 保健食品>有关问题的复函》(食药监食监三便函〔2015〕216号)规定执行。
05 功能性保健食品的产品说明书中标志性成分及含量的标示值的确定要求(2021-10-08)
答:按《保健食品注册申请服务指南》的要求,产品说明书中标志性成分及含量的标示值以产品技术要求中指标最低值标示。如某产品的技术要求中标志性成分含量为总黄酮≥900mg/100g,说明书中应标示为“每100g含:总黄酮900mg”;如某产品的技术要求中标志性成分含量为总黄酮500-900mg/100g,说明书中应标示为“每100g含:总黄酮500mg”。
06 酒剂产品标示产品说明书的注意事项要求(2021-10-08)
答:酒剂产品应在产品说明书注意事项中标示“对酒精过敏者慎用;本品不宜超量食用,不宜与其他酒类同时食用”。
07 不同原料的保健食品,不适宜人群标注要求(2021-10-08)
答:不同原料组方的保健食品,因原料本身的限制,其不适宜人群应当且不限于以下标注内容:
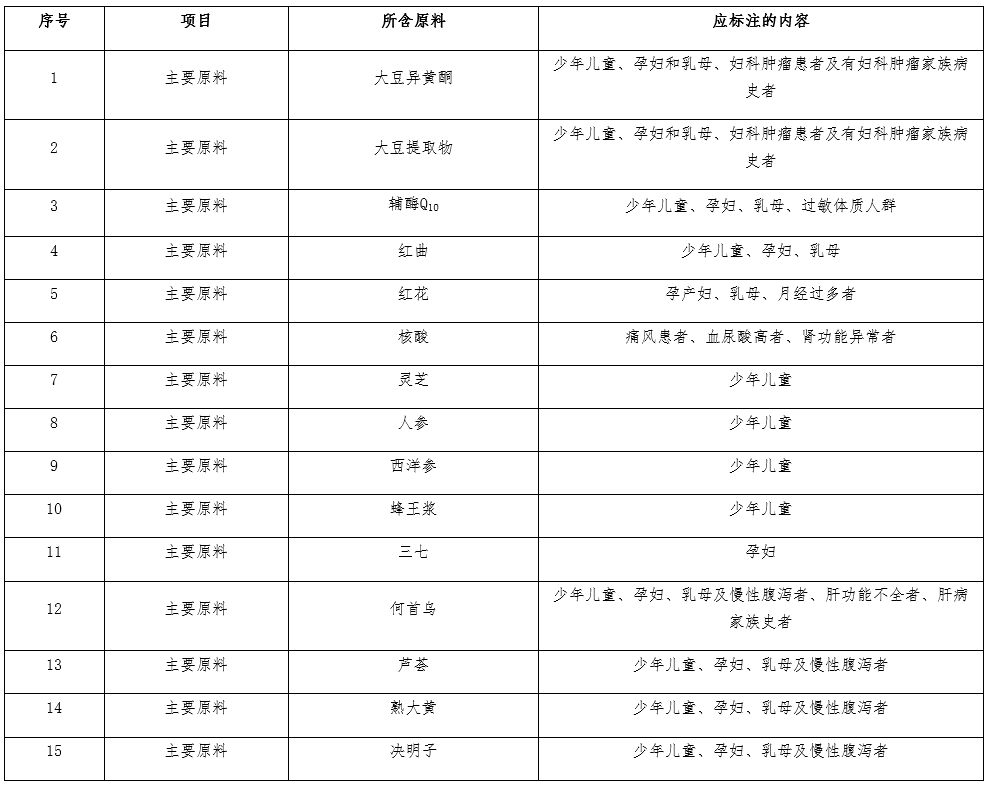
08 不同原料的保健食品,注意事项标注要求(2021-10-08)
答:不同原料组方的保健食品,因原料本身的限制,其注意事项应当且不限于以下标注内容:
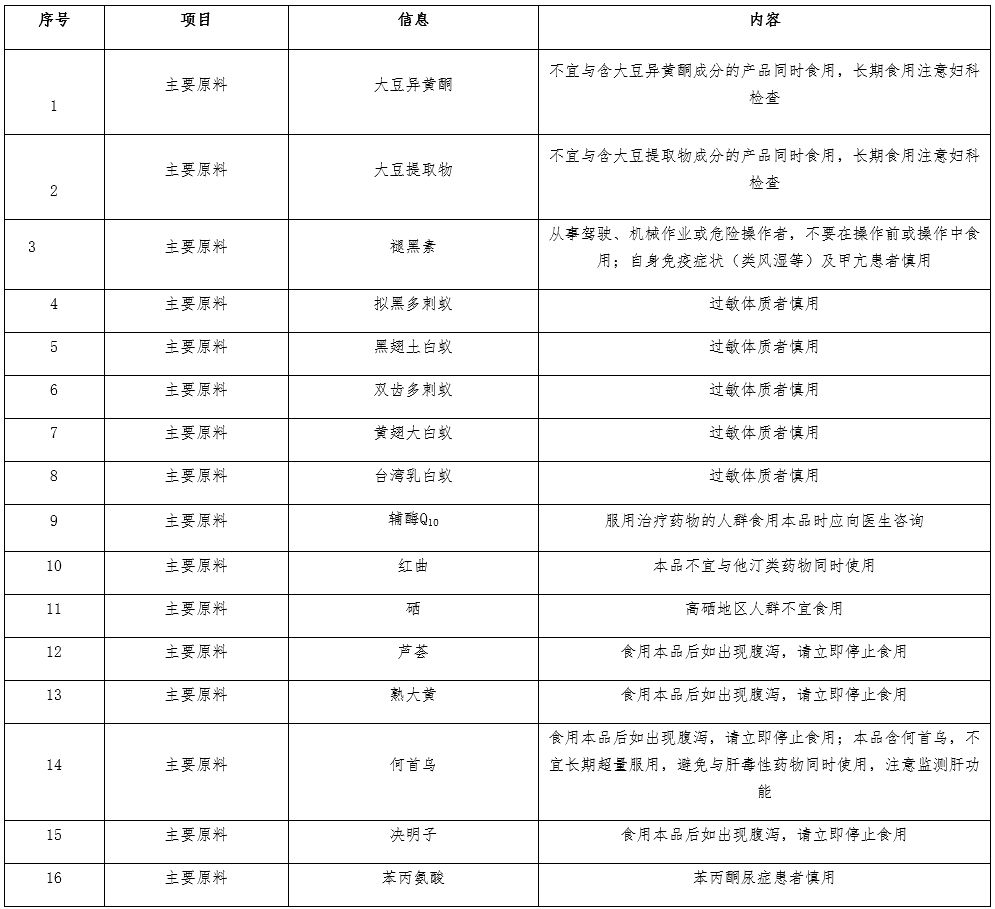
09 按审评意见需补充材料的新产品注册和延续注册(再注册)申请,产品标签说明书以及产品技术要求应补充完善哪些内容?(2021-09-23)
答:根据《关于保健食品注册审评审批工作过渡衔接有关事项的通告》(16年第172号),已受理属于注册管理范围的新产品注册和延续注册(再注册)申请,申请人应按照《保健食品注册审评审批工作细则》(2016年版)(以下简称《细则》)及《保健食品注册申请服务指南》(2016年版)(以下简称《指南》)等相关规定完善产品标签说明书以及产品技术要求。
一、产品标签说明书
按照《细则》及《指南》等相关规定,补充完善产品标签说明书内容,补充提供修订说明以及规范的标签说明书样稿。
【原料】按配方材料列出全部原料。各原料顺序按其在产品中的用量,由大到小排列。经辐照的原料,应在原料名称后标注“(经辐照)”。
【辅料】按配方材料列出全部辅料。各辅料顺序按其在产品中的用量,由大到小排列。经辐照的辅料,应在辅料名称后标注“(经辐照)”。
【功效成分或标志性成分含量】应包括成分名称及含量。应与产品技术要求中功效成分或标志性成分指标名称一致,以产品技术要求中指标最低值为标签说明书标示值。(营养素补充剂产品除外)
【适宜人群】应为与安全性、保健功能等科学依据相符的食用安全、有明确功能需求、适合本产品的特定人群。
【不适宜人群】应为适宜人群范围中应当除外的特定人群、现有科学依据不足以支持该产品适宜的婴幼儿、孕妇、乳母等特殊人群,以及现行规定明确应当标注的特定人群。暂无法确定不适宜人群的,应明确注明“限于目前科学研究水平,该产品暂未发现明确的不适宜人群,将根据收集到的食用安全信息,予以完善补充”。
【保健功能】应经研发综合确定,符合保健功能声称管理的相关要求。
【食用量及食用方法】应与产品配方配伍及用量的科学依据、安全性和保健功能试验评价材料等相符。
【规格】应为最小制剂单元的重量或者体积(不包括包装材料;胶囊剂指内容物;糖衣片或丸指包糖衣前的片芯或者丸芯),应与产品食用量及食用方法相匹配。酒类产品应注明酒精度。
【贮藏方法】应根据产品特性、稳定性试验等综合确定。贮藏方法为冷藏等特殊条件的,应列出具体贮藏条件。
【保质期】应经研发综合确定。以“××月”表示,不足月的以“××天”表示。
【注意事项】应注明“本品不能代替药物。适宜人群外的人群不推荐食用本产品”。必要时还应根据法规规定、研发情况、科学共识以及产品特性增加相应注意事项。
备注:
1、【功效成分或标志性成分含量】项,应以重新确认提交的技术要求中相应指标的最低值标示(营养素补充剂产品除外)。
2、【适宜人群】、【不适宜人群】项内容未按《指南》要求确定的,应按《指南》要求修改完善。修订后的内容较原确认提交的内容扩大了适宜人群范围或缩小了不适宜人群范围的,应说明理由并提供相应的科学证据。
3、【注意事项】内容应准确完备,需增加的内容应表述详明。
二、产品技术要求新增内容
1、【生产工艺】项
应以文字形式描述主要生产工艺,包括主要工序、关键工艺参数或参数合理范围等。非关键工艺的工艺参数可不提供。关键工艺是指产品生产过程中,对产品质量安全或保健功能有直接影响,不随着工艺规模、生产设备等客观变化必须进行参数调整的工艺。如:提取精制、干燥等工序的技术参数或参数合理范围,灭菌的方法及具体参数等。
示例1:本品经提取(提取溶剂、时间、次数、温度)、精制(D101大孔树脂,简述洗脱过程)、浓缩、真空干燥(××℃)、配制、过滤、热压灭菌(121℃,30min)、灌装、包装等主要工艺加工制成。
示例2:本品经混合、制粒、压片、包装等主要工艺加工制成。
2、【直接接触产品包装材料的种类、名称及标准】项
应以文字形式描述经研发确定的直接接触产品包装材料的种类、名称及标准。直接接触产品的包装材料的名称、种类、标准号和标准文本应完整,选择依据应符合现行规定。
示例:钠钙玻璃药瓶应符合《钠钙玻璃模制药瓶》(YBB00272002-2015);铝防伪瓶盖应符合《中华人民共和国包装行业标准 铝防伪瓶盖》(BB/T 0034-2006)。
3、【装量或重量差异指标/净含量及允许负偏差指标】项
应以文字形式描述装量或重量差异指标(净含量及允许负偏差指标)。《中华人民共和国药典》(以下简称《中国药典》)“制剂通则”项下有相应要求的产品剂型,标注“装量(或重量)差异指标应符合《中华人民共和国药典》中制剂通则项下XXXX的规定。
示例1(XXX片):重量差异指标应符合《中华人民共和国药典》中“制剂通则”项下片剂的规定。
示例2(XXX胶囊):装量差异指标应符合《中华人民共和国药典》中“制剂通则”项下胶囊剂的规定。
普通食品形态产品应制定净含量及允许负偏差指标,指标应符合《定量包装商品净含量计量检验规则》(JJF 1070)规定。
示例(XXX饮料):净含量为250mL/瓶,允许负偏差为9mL;150mL/瓶,允许负偏差为4.5%。
4、【原辅料质量要求】项
质量要求为国家标准、地方标准、行业标准的,应列出标准号;符合国家标准、地方标准、行业标准,且部分指标应同时符合企业标准的,应列出标准号或规范性文件的标题文号,同时以文字形式列出企业标准的指标项目及指标值。
为企业标准的,应以列表形式列出指标项目及指标值。无适用的国家标准、地方标准、行业标准的原料,还应列出主要生产工序和关键工艺参数。
对于以提取物为原料的产品,还应按《指南》完善提取物质量要求,包括原料来源(对动植物品种有明确要求的,应明确其具体品种,必要时写明原植物拉丁学名)、制法(包括主要生产工序、关键工艺参数等)、提取率(得率)、感官要求、一般质量控制指标(如水分、灰分、粒度等)、污染物指标(铅、总砷、总汞、提取溶剂残留等)、农药残留量、标志性成分指标(难以定量测定的应当制定专属性定性鉴别指标)、微生物指标(包括菌落总数、大肠菌群、霉菌和酵母、金黄色葡萄球菌、沙门氏菌)等。内容有缺项难以制定或无需制定的,原因应合理。
示例:银杏叶提取物
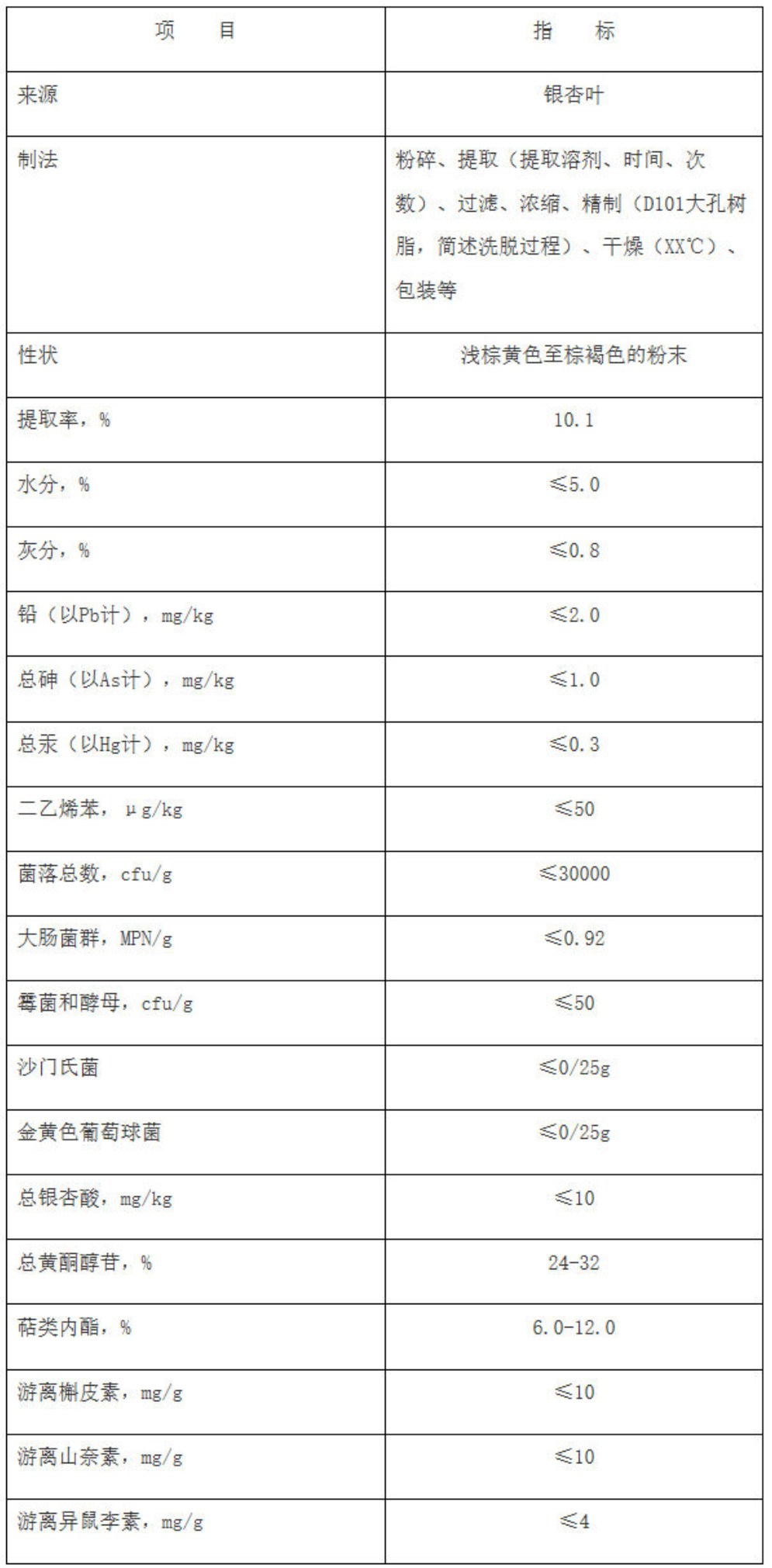
三、其它注意事项
1、补充提供的产品技术要求中原已认可内容不得更改,新增内容应与原已认可的生产工艺、企业标准、直接接触产品的内包装材料等相关内容保持一致。
2、产品标签说明书电子版本提交
登录市场监督管理总局食品审评中心网站(http://www.cfe-samr.org.cn/),上传规范完善后的标签说明书样稿,同时提交加盖申请人公章的标签说明书样稿、修订说明等补充资料。
注:1.问答来源:国家市场监督管理总局食品审评中心;
2.每个问题后括号中备注的日期为食品审评中心发布该问答的具体时间,以供参考;
3.“国家食品药品监督管理局”目前已改名为“国家市场监督管理总局”。
相关推荐:
- 2021年上半年保健食品注册类产品批件发布情况分析
- 保健食品常见问题与解答-备案篇(1):原辅料
- 备案稳定性实验如何执行?是否可以委托检测?保健食品常见问题与解答——备案篇(2):理化检验及质量标准
- 进口保健食品备案证明文件怎么出?保健食品常见问题与解答——备案篇(3):进口保健食品备案
- 备案保健食品信息如何填报?保健食品常见问题与解答——备案篇(4):其它
- 瑞旭再传捷报!17款进口保健食品备案产品发布,近半数由瑞旭申报成功!
我们的服务:
