根据国家市场监督管理总局发布的最新版本的《保健食品注册与备案管理办法》,保健食品在中国市场上市销售前,企业需要申请并获得保健食品注册证书或备案凭证。使用保健食品原料目录以外原料的国产保健食品和首次进口的保健食品(属于补充维生素、矿物质等营养物质的保健食品除外)都需要向国家市场监管总局(SAMR)申请注册。
保健食品在不同国家的名称
中国: Health Food (保健食品)
欧盟: Food Supplement(食品补充剂)
美国:Dietary Supplement(膳食补充剂)
加拿大:Natural Health Product(天然保健品)
澳大利亚:Complementary Medicines(辅助药类)
韩国: Health Functional Food(保健功能食品)
日本: Food with Health Claims (FHC)(保健声称食品)
在中国,什么是保健食品?
声称并具有特定保健功能或者以补充维生素、矿物质等营养物质为目的;
适用于特定人群食用;
具有调节机体功能,不以治疗疾病为目的;
对人体不产生任何急性、亚急性或慢性危害;
不同于一般(普通)食物和药品。
保健食品的类别
营养素补充剂: 补充维生素和(或)矿物质等营养物质,但无法提供能量或其它活性成分,不能声称任何保健功能。
功能性保健食品: 声称并具有特定保健功能且对人体具有生理效应。
功能性保健食品允许宣称的24种功能
序号 | 保健功能名称 | 序号 | 保健功能名称 |
1 | 有助于增强免疫力 | 13 | 有助于改善黄褐斑 |
2 | 有助于抗氧化 | 14 | 有助于改善皮肤水份状况 |
3 | 辅助改善记忆 | 15 | 有助于调节肠道菌群 |
4 | 缓解视觉疲劳 | 16 | 有助于消化 |
5 | 清咽润喉 | 17 | 有助于润肠通便 |
6 | 有助于改善睡眠 | 18 | 辅助保护胃粘膜 |
7 | 缓解体力疲劳 | 19 | 有助于维持血脂(胆固醇/甘油三酯)健康水平 |
8 | 耐缺氧 | 20 | 有助于维持血糖健康水平 |
9 | 有助于控制体内脂肪 | 21 | 有助于维持血压健康水平 |
10 | 有助于改善骨密度 | 22 | 对化学性肝损伤有辅助保护作用 |
11 | 改善缺铁性贫血 | 23 | 对电离辐射危害有辅助保护作用 |
12 | 有助于改善痤疮 | 24 | 有助于排铅 |
保健食品注册相关法律法规
名称 | 发行日期 | 施行日期 |
中华人民共和国食品安全法(2021年修订版) | 2015.04.24(2021.04.29修订) | 2015.10.01 |
2016.02.26(2020.11.03修订) | 2016.07.01 | |
2014.12.24 | 2015.05.24 | |
2016.11.14 | 2016.11.14 | |
2016.12.19 | 2016.12.19 | |
2020.10.31 | 2020.10.31 | |
2020.10.31 | 2020.10.31 | |
2020.10.31 | 2020.10.31 | |
2023.08.31 | 2023.08.31 | |
2023.08.31 | 2023.08.31 | |
2023.08.31 | 2023.08.31 | |
2023.08.31 | 2023.08.31 | |
2019.08.20 | 2020.01.01 | |
2019.11.12 | 2019.11.12 |
哪些保健食品需要申请保健食品注册?
国产:使用保健食品原料目录以外原料的保健食品
进口:首次进口的保健食品(属于补充维生素、矿物质等营养物质的保健食品除外)
PS. 保健食品原料目录目前包含《保健食品原料目录 辅酶Q10,破壁灵芝孢子粉,螺旋藻,鱼油,褪黑素》、《保健食品原料目录 大豆分离蛋白》、《保健食品原料目录 乳清蛋白》、《保健食品原料目录 人参,西洋参,灵芝》和《保健食品原料目录 营养素补充剂(2023年版)》
保健食品注册申请人资质要求
国产保健食品注册申请人应当是在中国境内登记的法人或者其他组织。
进口保健食品注册申请人应当是上市保健食品的境外生产厂商(境外生产厂商,是指产品符合所在国(地区)上市要求的法人或者其他组织)。
换言之,无论是国产的保健食品还是进口的保健食品,都允许委托生产。
保健食品注册流程
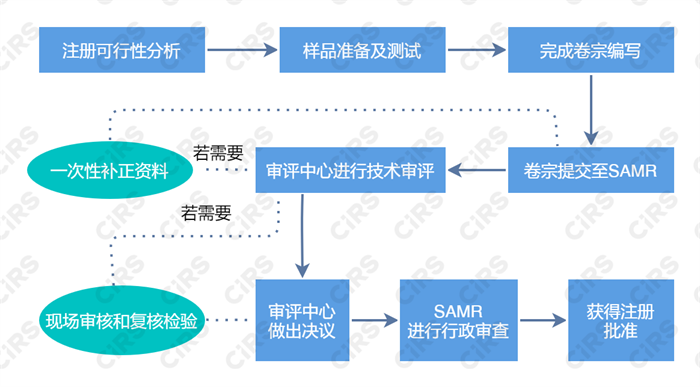
保健食品注册材料要求
1) 保健食品注册申请表,以及申请人对申请材料真实性负责的法律责任承诺书;
2) 注册申请人主体登记证明文件复印件;
3) 产品研发报告,包括研发人、研发时间、研制过程、中试规模以上的验证数据,目录外原料及产品安全性、保健功能、质量可控性的论证报告和相关科学依据,以及根据研发结果综合确定的产品技术要求等;
4) 产品配方材料,包括原料和辅料的名称及用量、生产工艺、质量标准,必要时还应当按照规定提供原料使用依据、使用部位的说明、检验合格证明、品种鉴定报告等;
5) 产品生产工艺材料,包括生产工艺流程简图及说明,关键工艺控制点及说明;
6) 安全性和保健功能评价材料(包括三批次稳定性试验报告,动物毒理试验报告,动物功能试验报告,人体试食试验报告等);
7) 直接接触保健食品的包装材料种类、名称、相关标准等;
8) 产品标签、说明书样稿;
9) 产品名称中的通用名与注册的药品名称不重名的检索材料、产品名称与批准注册的保健食品名称不重名的检索材料;
10) 3个最小销售包装样品;
11) 其他与产品注册审评相关的材料。
申请首次进口保健食品注册,还应当提交下列材料:
1) 产品生产国(地区)、政府主管部门或者法律服务机构出具的注册申请人为上市保健食品境外生产厂商的资质证明文件;
2) 产品生产国(地区)政府主管部门或者法律服务机构出具的保健食品上市销售一年以上的证明文件;
3) 产品生产国(地区)或者国际组织与保健食品相关的技术法规或者标准,保证生产质量管理体系有效运行的自查报告,符合良好生产质量管理规范的证明文件;
4) 产品在生产国(地区)上市的包装、标签、说明书实样。
5) 由境外注册申请人常驻中国代表机构办理注册事务的,应当提交《外国企业常驻中国代表机构登记证》及其复印件;境外注册申请人委托境内的代理机构办理注册事项的,应当提交经过公证的委托书原件以及受委托的代理机构营业执照复印件。
保健食品注册申报周期
从初期的资料准备和样品检测到官方审评,保健食品的注册申报周期通常为2到3年。
我们的服务
瑞旭其他热门服务:
相关阅读:
